IgA腎病是一種慢性自身免疫性疾病,超過50%的患者在初次診斷後20年內進展為終末期腎病。TARPEYO前稱為Nefecon,為Budesonide/布地奈德緩釋膠囊製劑,這是首個經FDA批准的專門針對該疾病的治療。
這是一種皮質類固醇,據推測靶向迴腸中的黏膜B細胞,包括負責產生導致IgA腎病的半乳糖缺陷型IgA1抗體(Gd-Ag1)的派爾集合淋巴結。根據最新的3期試驗的中期結果,布地奈德可改善成年IgA腎病患者的尿蛋白與肌酐比值(UPCR)並維持腎小球濾過率估計值(eGFR)。該試驗發表在了《國際腎臟》。
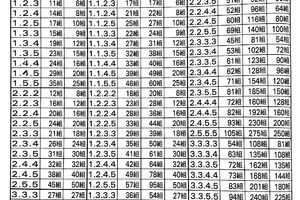
在雙盲NefIgArd試驗(NCT03643965)的A部分中,研究人員將199名儘管穩定、優化了腎素-血管緊張素系統阻滯但仍出現IgA腎病和持續性蛋白尿的患者隨機分配到布地奈德(16mg/d)或安慰劑治療9個月。起始時,中位UPCR為1.26g/g,中位蛋白尿為2.26g/24小時(58%的蛋白尿在24小時內達到2g或更多)。中位eGFR為55mL/min/1.73m²。

研究員Brad H.Rovin醫學博士及其同事在《國際腎臟》雜誌上報告,在9個月和12個月時,布地奈德與安慰劑組相比,24小時UPCR分別顯著降低了27%和48%。此外,布地奈德組9個月時的eGFR保持不變,安慰劑組較起始下降0.17和4.04mL/min/1.73m²。
在安全性方面,布地奈德組有86.6%,安慰劑組為73.0%發生了治療中出現的不良事件(TEAE)。研究人員報告說,大多數TEAE是輕度至中度(1%重度)和可逆的。布地奈德組最常見的TEAE是高血壓、外周水腫、肌肉痙攣和痤瘡。布地奈德組和安慰劑組分別有39.2%和41.0%發生感染。沒有患者出現需要住院的嚴重感染。布地奈德組和安慰劑組分別有9.3%和1.0%的患者停止治療。
Rovin博士的團隊寫道:「這是第一個3期隨機對照試驗,證明使用我們假設可能針對IgA腎病潛在病理生理學的藥物具有如此大的治療效益。」。試驗B部分的結果預計在2023年得出,並將告知FDA批准。
參考來源:Barratt J, Lafayette R, Kristensen J等人。『Results from part A of the multi-center, double-blind, randomized, placebo-controlled NefIgArd trial evaluated targeted-release formulation of budesonide for the treatment of primary immunoglobulin A nephropathy』,《Kidney Int》。2022年10月18日在線發布;doi:10.1016/j.kint.2022.09.017
註:本文旨在介紹醫藥健康研究,不作任何用藥依據,具體用藥指引,請諮詢主治醫師。