終末期肝病(ESLD)指各種慢性肝臟損害所致的肝病晚期階段,主要特徵為肝臟功能不能滿足人體的生理需求,包括各種慢性肝病的終末期階段,表現為肝功能嚴重受損和失代償,包括慢加急性肝功能衰竭(ACLF)、肝硬化急性失代償、慢性肝功能衰竭和晚期肝細胞癌。感染可以誘發或加重ESLD,也是ESLD最常見的併發症之一,ESLD合併感染是造成ESLD死亡的主要原因,因此其治療管理極為重要。
在中華醫學會肝病學分會成立30周年大會暨2022年中華醫學會肝病學分會學術年會上,南京大學醫學院附屬鼓樓醫院感染病科吳超教授在主題報告中,分享了ESLD合併感染的抗菌藥物選擇、抗菌藥物在ESLD中的藥代動力學特點與血藥濃度監測、人工肝支持時抗菌藥物的應用等方面的進展。
一、ESLD合併感染現狀和藥物選擇
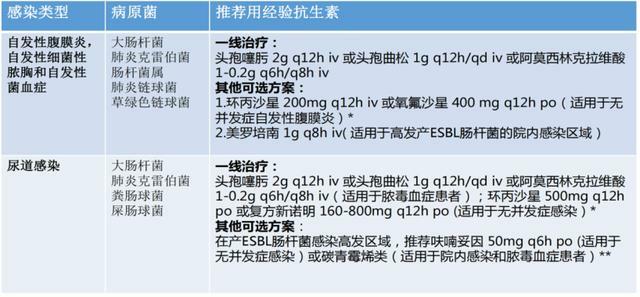
ESLD合併感染原因包括腸道微生態改變、細菌移位、遺傳易感性、免疫功能受損、激素、營養不良、有創操作和細菌定植增加等。感染部位包括腹腔、呼吸道、膽道、泌尿道、血流、胃腸道、皮膚軟組織等,自發性腹膜炎最常見;常見病原體包括大腸埃希菌、葡萄球菌、肺炎克雷伯菌、腸球菌、念珠菌、麴黴菌。
ESLD合併感染往往導致器官功能衰竭及死亡風險增加、多重耐藥(MDR)感染增加、抗菌藥物療效下降。全球肝硬化和細菌感染者的MDR發生率約為34%。ESLD合併感染的常見部位、病原菌和經驗用藥見表1。
表1. ESLD合併感染的常見部位、病原菌和經驗用藥

二、抗菌藥物在ESLD中的藥代動力學特點
由於ESLD的病理生理學特點,抗菌藥物藥代動力學(PK)特徵會發生相應變化(圖1)。
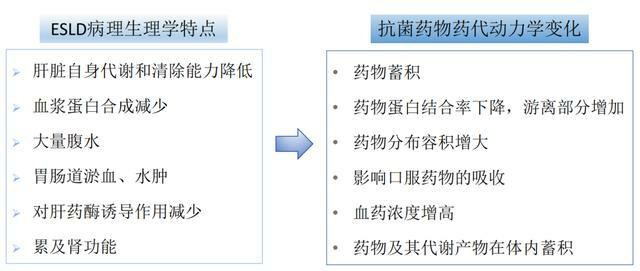
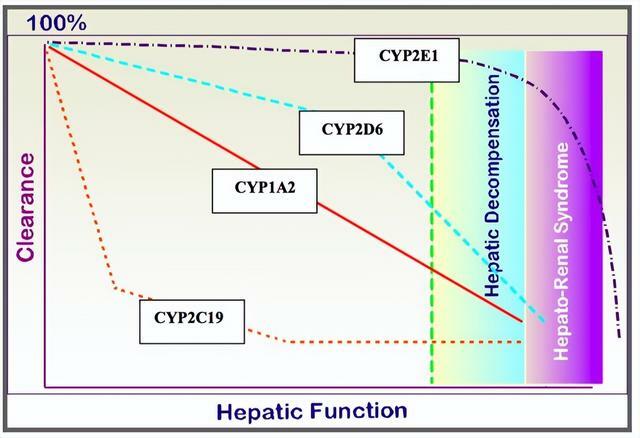
研究顯示,細胞色素P450(CYP450)酶系統是藥物代謝的關鍵酶,藥物通過CYP450清除,隨著肝功能惡化,藥物清除下降。不同藥物經不同肝代謝酶代謝,即使肝功能水平類似,血藥濃度也有差異(圖2)。
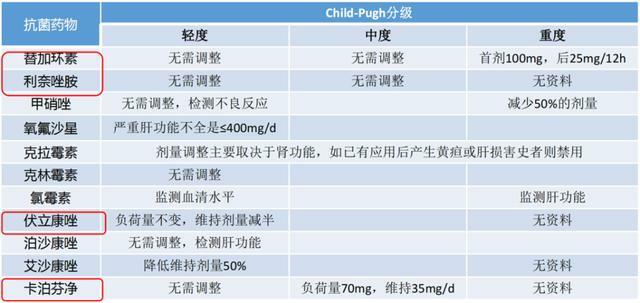
三、常見抗菌藥物在ESLD中的濃度監測和劑量調整
隨排泄途徑不同,常見抗菌藥物在ESLD中的使用分為慎用、必要時減量、減量和無需調整(圖3)。

抗菌藥物在ESLD合併感染患者中的使用,需要根據治療藥物監測(TDM)設計或調整給藥方案,以提高藥物的療效和減少不良反應的發生。TDM更適用於ESLD患者、危重症患者。常見抗菌藥物在ESLD中的劑量調整如表2。
表2.常見抗菌藥物在ESLD中劑量調整
替加環素(甘氨醯環素類抗菌藥物)
⑴推薦劑量:負荷劑量100 mg,後維持劑量50 mg q12h;
⑵PK/PD分類:時間依賴性,具有較長的抗生素後效應(PEA);
⑶最佳PK/PD指數:AUC0-24/MIC;
⑷臨床療效靶值:12.8-17.9。
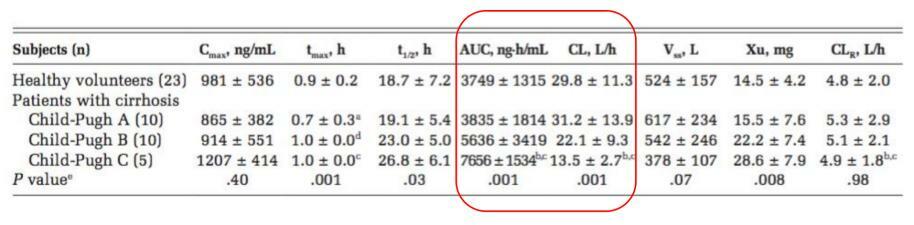
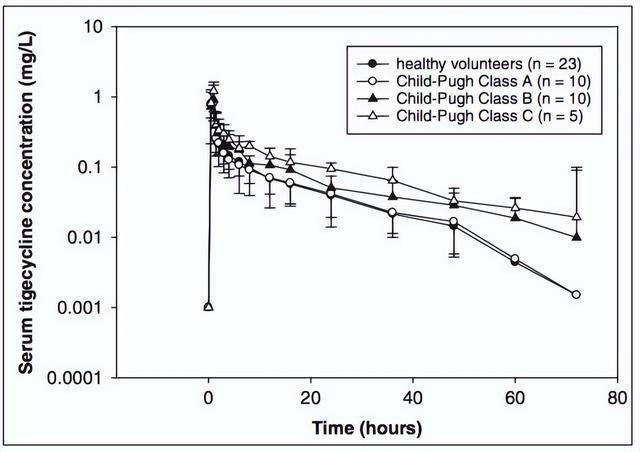
2011年一項評估替加環素在不同程度肝硬化中的PK特點的研究,受試者包括肝硬化組25例(其中Child-Pugh A級10例,B級10例,C級5例)和健康對照組23例,100 mg靜脈滴注單次給藥,給藥後按時間點留取血樣檢測血藥濃度。
結果顯示,100 mg負荷劑量後,PK方面,Child-Pugh A級與健康對照組的PK差異不大,Child-Pugh B和C級患者AUC顯著增加,清除顯著下降(表3);血藥濃度方面,Child-Pugh A級與健康對照組無顯著差異,Child-Pugh B和C級患者血藥濃度較高(圖4)。
表3.替加環素在不同程度肝硬化中的PK特點
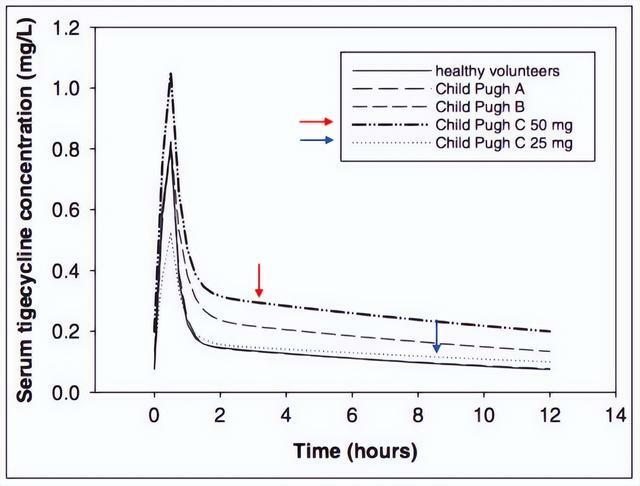
2室模型模擬不同維持劑量在肝硬化中的血藥濃度特點:負荷劑量100 mg,維持劑量50 mg q12h(Child-Pugh C級)血藥濃度顯著升高;負荷劑量100 mg,維持劑量25 mg q12h(Child-Pugh C級)血藥濃度與健康對照相似(圖5)。
這項研究提示,輕中度肝功能損害的患者對替加環素耐受性良好,可應用標準劑量;嚴重肝功能受損患者替加環素維持劑量建議減半應用。
利奈唑胺(噁唑烷酮類抗菌藥物)
⑴推薦劑量:600 mg q12h;
⑵PK/PD分類:時間依賴性,具有較長的PEA;
⑶最佳PK/PD指數:AUC0-24/MIC;
⑷臨床療效靶值:≥80。
2019年一項評估利奈唑胺治療肝硬化患者的PK與安全性的研究,受試者包括肝硬化組26例(Child-Pugh A級1例,B級13例,C級12例)和對照組26例,給藥方案為600 mg q12h,3天後測血藥濃度。2組PK比較見表3。
表3. 利奈唑胺在不同程度肝硬化中的PK比較
結果表明,肝硬化患者出現利奈唑胺血藥濃度升高(>10 mg/L)是非肝硬化患者的11.4倍,利奈唑胺的血藥濃度與乳酸水平呈正相關。肝硬化患者中標準劑量(600 mg q12h)利奈唑胺血藥濃度顯著升高,發生血小板減少及需要輸注血小板比例顯著升高,提示肝硬化患者在應用利奈唑胺治療時應行TDM,全面評估療效及安全性。
伏立康唑(吡咯類、三唑類抗真菌藥物)
⑴推薦劑量:負荷劑量6 mg/kg q12h(D1),維持劑量4 mg/kg q12h;
⑵PK/PD分類:時間依賴性,具有較長的PEA;
⑶最佳PK/PD指數:AUC0-24/MIC或Cmin;
⑷臨床療效靶值:AUC0-24/MIC>20,或Cmin 2mg/L。
2018年一項評估伏立康唑治療Child-Pugh B級和C級肝硬化患者的療效與安全性的研究,分為標準治療組(伏立康唑200 mg q12h,靜脈或口服)和減半劑量組(伏立康唑負荷量200 mg q12h D1,維持劑量100 mg q12h),共78例患者入組,3天達到穩態後留取血藥濃度。
結果顯示,標準治療組伏立康唑藥物濃度顯著高於低劑量組(6.95 mg/L vs. 4.02 mg/L),Child-Pugh分級對藥物濃度無顯著影響,減半劑量組INR水平、應用CYP2C19抑制劑是影響伏立康唑血藥濃度的危險因子(表4)。
表4. 減半劑量組的單因素和多因素分析

不良反應方面,2組分別為9例和7例,發生率無差異。不良反應組和無不良反應組血藥濃度分別為5.90±2.40 mg/L和5.22±3.20 mg/L(P=0.37)。發生不良反應者,標準治療組平均血藥濃度6.52 mg/L,低劑量組4.76 ml/L。87.5%的不良反應發生在7天內。研究提示,在Child-Pugh B級和C級的肝硬化患者中,即使伏立康唑的維持劑量減半,血藥濃度仍顯著增高,需早期監測血藥濃度。
西安交通大學第一附屬醫院趙英仁教授開展的肝衰竭患者應用伏立康唑的風險及影響因素研究中,受試者包括肝衰竭組58例和早中期肝硬化組23例,負荷量6 mg/kg,維持量2 mg/kg,3天達到穩態後留取血藥濃度。
結果顯示,肝衰竭組伏立康唑血藥濃度明顯高於早中期肝硬化組(P=0.036),肝衰竭患者中伏立康唑血藥濃度異常發生率高於早中期肝硬化組(P=0.010)。多因素回歸分析顯示,INR是影響肝衰竭患者中伏立康唑血藥濃度升高的獨立預測因素(OR=4.007, P=0.033)。INR預測伏立康唑血藥濃度異常AUC為0.746,最佳臨界值為1.67,判斷伏立康唑血藥濃度異常的陽性靈敏度為95%,特異性為50%(圖6)。
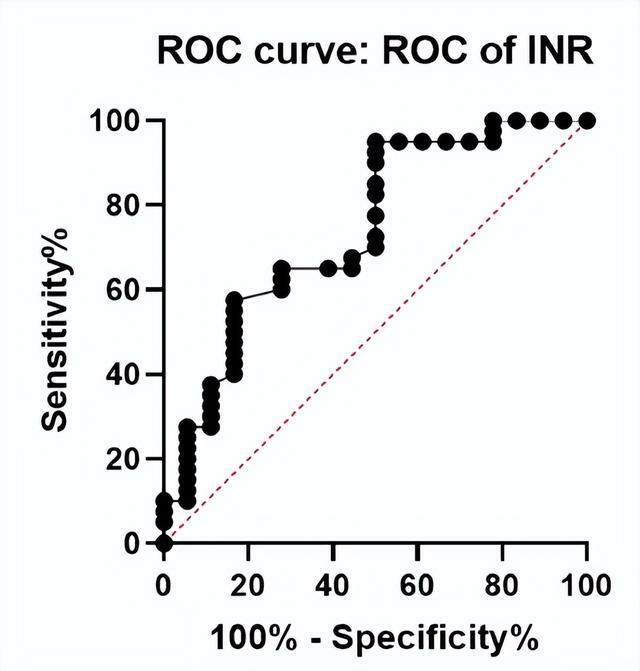
研究提示,肝衰竭患者應用伏立康唑維持劑量減半時,仍易出現血藥濃度升高;INR是影響伏立康唑血藥濃度升高的獨立預測因素。INR>1.67發生伏立康唑血藥濃度升高的比例明顯增加。
卡泊芬淨(棘白菌素類)
⑴推薦劑量:負荷劑量70 mg,維持劑量50 mg qd;
⑵PK/PD分類:口服不吸收,濃度依賴性,具有較長的抗真菌藥物後效應(PAFE);
⑶最佳PK/PD指數:fCmax/MIC或fAUC0-24/MIC(fCmax:游離Cmax,fAUC:游離AUC);
⑷臨床療效靶值:fCmax/MIC>10或fAUC0-24/MIC>20。
2021年一項研究顯示,卡泊芬淨可以用於ESLD患者,可降低侵襲性麴黴病的發生。2007年一項評估卡泊芬淨在輕中度肝損傷患者中的藥代動力學變化的研究,給藥方案為對照組、輕度肝損傷組(卡泊芬淨負荷量70 mg,維持量50 mg qd)、中度肝損傷組(卡泊芬淨負荷量70 mg,維持量35mg qd)。
結果顯示,中度肝損傷(卡泊芬淨減量組)與對照組卡泊芬淨AUC差異無統計學意義。輕度肝損傷組與對照組相比,卡泊芬淨AUC升高(有統計學意義),但血藥濃度升高幅度不大,故卡泊芬淨在輕度肝損傷者可不調整劑量。
該研究提示,卡泊芬淨在輕中度肝損傷患者中耐受性良好,中度肝損傷患者建議維持劑量減量至35 mg qd。
萬古黴素(糖肽類)
⑴推薦劑量:500 q6h或1.0g q12h,重症感染負荷劑量25~30 mg/kg;
⑵PK/PD分類:時間依賴性,具有較長的PEA;
⑶最佳PK/PD指數:AUC0-24/MIC,Cmin;
⑷臨床療效靶值:AUC0-24/MIC 400-600,Cmin 15-20mg/L。
2019年一項研究旨在評估不同Child-Pugh分級的肝硬化患者中萬古黴素的劑量。結果顯示,不同Child-Pugh分級的患者萬古黴素血藥濃度差異無統計學意義。研究提示,肝硬化失代償期患者存在潛在的腎功能損害,儘管應用低於標準劑量的治療方案(2 g/24 h vs. 3 g/24 h),肝硬化失代償期患者萬古黴素濃度仍較高。
四、人工肝支持時抗菌藥物的應用
人工肝是替代肝臟部分功能的體外支持系統,是治療肝衰竭的有效方法,包括非生物型、生物型和混合型。非生物型技術包括血漿置換(TPE)、血液吸附、血液灌流和分子吸附再循環系統(MARS)。非生物型人工肝通過特殊的濾器將大部分血漿成分在體外進行分離、置換和吸附,達到清除體內大分子物質的目的,但同時也能清除部分抗菌藥物,影響其療效和安全性。
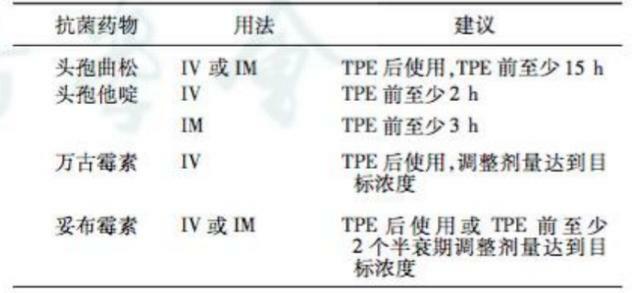
抗菌藥物在TPE中清除的重要決定因素包括藥物與TPE兩方面。藥物方面,TPE期間藥物濃度越高、蛋白結合率(PB)越高(>80%)、表觀分布容積越小(<0.2L),越容易被清除;TPE方面,與持續時間、TPE的頻次、置換總量及液體種類相關。TPE時對高蛋白結合率抗菌藥物用藥建議見表5。而MARS通過白蛋白透析清除蛋白結合毒素及水溶性毒素,PB越高,越容易被清除。
表5. TPE時對高蛋白結合率抗菌藥物用藥建議
綜上,建議儘量避免人工肝治療過程中應用抗菌藥物,治療過程中進行TDM以指導治療。
小 結
抗菌藥物在終末期肝病中藥代動力學發生變化。需要調整劑量的常用抗菌藥物包括頭孢曲松、頭孢哌酮、替加環素、利奈唑胺、伏立康唑、卡泊芬淨等。需關注人工肝支持對抗菌藥物藥代動力學影響。ESLD患者用藥過程中需行TDM,以精準評估療效及安全性。
參考文獻:
1. World J Gastroenterol, 2018, 24(38): 4311-4329.
2. 中華肝臟病雜誌, 2020.], 28: 545-547
3. Gastroenterology, 2019: 1-13
4. Jalan R, et al. J Hepatol. 2014 Jun;60(6):1310-24
5. Clin Pharmacol Ther, 2006, 80: 235- 45
6. J Clin Pharmacol, 2011,51: 93- 101 .
7. Ther Drug Monit, 2019, 41: 732- 739
8. International Journal of Infectious Diseases, 2018, 72: 49- 54
9. Transpl Infect Dis, 2021, 00: e13568
10. Hospital Pharmacy, 2019, 54(2): 125- 129.
11. 中華結核與呼吸雜誌, 2018,41: 409-446
12. Pharmacotherapy, 2015, 35: e136- e139.
13. Antimicrobial Agents and Chemotherapy, 2020,64: e01782-19.
14. Pharmacotherapy, 2020, 40: 1061-1068.
15. Transpl Infect Dis, 2013, 15: 214-218 .

專家簡介
吳超
主任醫師,教授、博士生導師
江蘇省醫學會感染病學分會主任委員
中華醫學會感染病分會委員
中華醫學會肝病分會委員
南京大學病毒與感染病研究所所長
美國肝病研究學會(AASLD)、歐洲肝臟研究學會(EASL)會員
歐洲臨床微生物與傳染病學會(ESCMID 會員
承擔多項國家自然科學基金、國家「十三五」傳染病重大專項子課題及省部級科研項目,在研科研經費2000餘萬元。
發表第一及通訊作者學術論文130 余篇,其中SCI 收錄130 余篇; 累計影響因子>1000,最高影響因子 71.071,包括Lancet Infect Dis,Hepatology,J Hepatol,JAMA NETWORK等期刊。
往期推薦
肝病年會丨汪安江教授:異位靜脈曲張的內鏡治療新進展
肝病年會丨竇曉光教授:精準免疫分期指導慢B肝抗病毒治療
肝病年會丨鄭明華教授:NAFLD新藥研發受試者篩選成功因素探討
肝病年會丨謝青教授:從篩查入手,擴大慢B肝治療人群,儘早實現治療目標