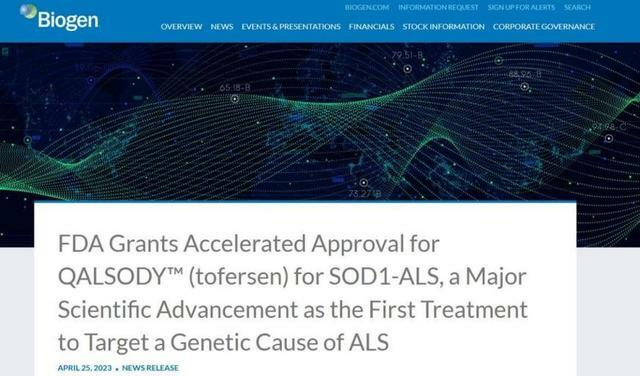
(人民日報健康客戶端記者 高瑞瑞)4月25日,據渤健官網消息,渤健/lonis聯合宣布FDA已同意加速批准反義寡核苷酸療法tofersen上市,用於治療超氧化物歧化酶1 (SOD1)突變所致的肌萎縮側索硬化(ALS)患者。
ALS俗稱漸凍症,SOD1-ALS是ALS的一種罕見遺傳性形式,僅占全球約16.8萬ALS病例的2%,大多患者疾病進展迅速,發病後生存期不超過3年。
「ALS的基因靶向療法對於基因明確為SOD1患者可能減少腦脊液SOD1蛋白濃度和神經絲纖維輕鏈水平,但是否最終改善臨床預後仍有待觀察和驗證。」首都醫科大學附屬北京天壇醫院神經內科主治醫師任雨婷告訴人民日報健康客戶端記者,目前已報導超50個基因與ALS致病或修飾有關,其中C9orf72、SOD1、TARDBP和FUS為最常見的四種相關致病基因。
據悉,這款藥物由渤健與lonis共同開發,是一種用於治療SOD1-ALS的反義寡核苷酸藥物,可與編碼SOD1的mRNA結合,使其被核糖核酸酶降解,從而減少SOD1蛋白的產生。
2022年7月,FDA受理該產品的上市申請並授予優先審評資格,將處方藥申報者付費法案(PDUFA)日期定為2023年1月15日;同年10月,渤健宣布FDA推遲了審批時間,PDUFA延期3個月至2023年4月25日。本次獲批上市主要是基於健康志願者中的I期臨床試驗、I/II期多劑量爬坡臨床試驗、III期臨床試驗VALOR以及開放標籤擴展 (OLE)的研究結果,同時也包含了近12個月VALOR和OLE研究的整合結果。
「最新研究證實SOD1突變患者接受Tofersen治療可減少受試者腦脊液SOD1蛋白濃度和血漿神經絲纖維輕鏈水平,但未觀察到臨床終點事件改善且伴有腰穿相關不良事件。早期接受Tofersen治療能否獲益將在後續試驗中進行評估。研究者表示將在後續的擴展試驗期進一步評估早期接受Tofersen治療較延遲治療的潛在影響。」任雨婷建議,目前仍需嚴格把控相關治療適應症,客觀評價臨床獲益和風險,常規告知患者腰穿治療風險及可能的臨床不確定性獲益。