腦卒中後認知障礙(post-stroke cognitive impairment,PSCI)定義為卒中後發生任何類型的認知惡化,範圍從認知損傷到痴呆[1],主要表現為失語、記憶缺陷及視覺空間、注意力和執行功能障礙,長期認知功能障礙對患者日常生活造成嚴重危害。PSCI發病機制複雜,相關的神經病理學基礎包括氧化應激、炎症和細胞死亡等[2]。目前,為了改善臨床結局,急性缺血性卒中患者的最佳治療方案包括靜脈注射組織纖溶酶原激活劑和血管內血栓切除術。然而,由於缺血性卒中的治療時間窗口狹窄,只有少數患者接受溶栓或血管內治療。為了解決目前卒中治療方法的短缺問題,確定新的潛在治療靶點十分重要[3]。
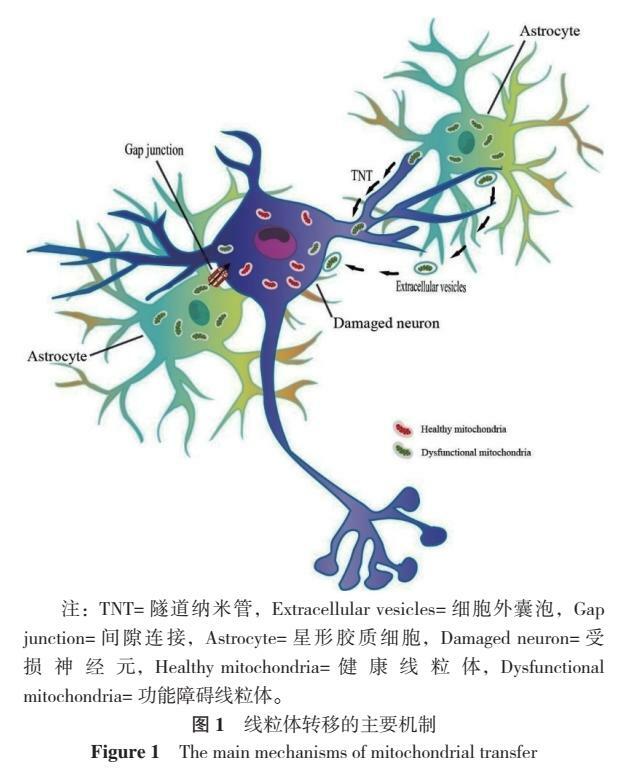
線粒體通過氧化磷酸化和產生三磷酸腺苷(ATP)提供驅動細胞生理功能的能量,其功能障礙包括一系列線粒體缺陷,例如生物能量損傷、產生大量活性氧(reactive oxygen species,ROS)、線粒體自噬功能障礙和線粒體動力學改變等。因此在PSCI的發病機制中,健康的線粒體起著至關重要的作用[3-4]。最近,細胞間線粒體轉移被認為是一種新型的細胞間信號傳導形式,該過程是通過細胞間隧道納米管(tunneling nanotubes,TNT)、細胞外囊泡(extracellular vesicles,EV)、間隙連接(gap junction,GJ)或其他途徑將整個線粒體轉移出供體細胞,隨後線粒體被受體細胞內化納入或進一步處理以進行降解[5]。本綜述側重於線粒體轉移在PSCI中的具體作用,以期為臨床防治PSCI提供潛在靶點及理論依據。
本文文獻檢索策略:計算機檢索PubMed、Web of Science、中國知網(CNKI)、萬方數據知識服務平台等資料庫,檢索時間為建庫至2023年1月,中文檢索詞包括「腦卒中後認知障礙」「線粒體轉移」「隧道納米管」「細胞外囊泡」「間隙連接」,英文檢索詞包括「mitochondrial transfer」「tunneling nanotubes」「extracellular vesicles」「gap junction」「post-stroke cognitive impairment」。文獻納入標準:文獻內容涉及線粒體轉移對PSCI的影響、線粒體轉移的神經生物學機制。文獻排除標準:與本文主題無關聯的文獻、質量較差的文獻、無法獲取全文的文獻等。最終納入文獻71篇。
1 線粒體轉移的結構機制
1.1 TNT TNT是直徑在50~150 nm的長距離管狀結構或突起,依賴於細胞骨架纖維來源的肌動蛋白和微管,是不同細胞成分的運輸途徑[6]。值得注意的是,TNT介導的轉移可以是單向的,也可以是雙向的。誘導線粒體損傷的各種危險因素可以促進TNT的形成和線粒體的轉移,但很少有研究關注TNT的起始機制和調節。
TNT是開放式膜肌動蛋白導管,膜和細胞骨架動力學的調節可能在TNT的生物發生中起主要作用。有研究顯示,細胞骨架的主要調節因子——經典的GTP酶Rho家族(Rac1、Cdc42和RhoA)與TNT形成有關[7]。Miro 1和Miro 2是一類新型Rho-GTP酶[8],將線粒體與KLF 5驅動蛋白結合,共同形成一種運動適配器複合物,有助於線粒體運輸並調節線粒體在微管上的運動[9]。此外,TSENG等[10]研究還表明,Miro 1是TNT形成和神經元存活的必需物質。間充質幹細胞(mesenchymal stem cell,MSC)Miro1過表達後線粒體轉移的效率越高,其積極作用就越高。據報導,大多數腦細胞,包括星形膠質細胞(astrocyte,AST)、神經元和小膠質細胞,通過TNT形成和線粒體轉移對各種損傷做出反應,例如AST和小膠質細胞可以通過TNT相互影響,可能是清除大腦內有害蛋白質聚集體的重要機制[11]。WANG等[12]研究發現,在AST-神經元共培養中,暴露於應激刺激的細胞與未受刺激細胞建立TNT聯繫。同時,在神經元和AST之間形成的TNT的神經元接觸位點觀察到連接蛋白43(connexin-43,Cx43)高表達[13]。Cx43在TNT的調節中起關鍵作用,降低Cx43的表達顯著影響了TNT的形成,並減少了線粒體轉移[14]。壓力條件同樣誘發TNT的形成,當細胞暴露於與ROS水平升高相關的缺血損傷時,線粒體以更有效的方式從MSC轉移到AST和PC12細胞。
此外,據報導,Wnt/Ca2+通過參與肌動蛋白細胞骨架重塑的細胞內級聯反應,在TNT形成和TNT介導的物質轉移中發揮作用[15];核因子κB(nuclear factor-kappa B,NF-κB)輕鏈增強子信號通路的活化刺激了腫瘤壞死因子α誘導蛋白2(tumor necrosis factor α-induced protein 2,TNFαip2)的表達,誘發F-肌動蛋白聚合,促進TNT的形成,抑制NF-κB途徑,減少TNT有益作用[16]。進一步研究發現,TNT介導的線粒體轉移主要表現為線粒體呼吸鏈的恢復、線粒體膜電位的增加以及ROS水平和細胞凋亡率的降低[17]。
1.2 EV EV由CHARGAFF和WEST在1940年發現,是細胞分泌的微小囊泡顆粒,其有兩種主要類型:外泌體和微囊泡(microvesicle,MV)。與其他形式的細胞間通訊,如激素、生長因子、細胞因子等直接相互作用不同,EV的獨特之處在於其能包裝活性物質,例如較小的囊泡可能含有線粒體片段,包括線粒體蛋白和(mitochondrial DNA,mtDNA),而較大的顆粒可能含有整個功能性線粒體,並將其遞送到另一個相鄰或遙遠的細胞,從而改變受體細胞的功能[18]。
神經幹細胞(neural stem cells,NSCs)通過EV運輸功能性線粒體,誘導中樞神經系統疾病動物模型的恢復[19];AST通過EV調節神經元功能,促進突觸形成並維持其正常功能[20];由MSC衍生的EV中,平均大小為250 nm的含有功能齊全的線粒體[21],轉移到肝內中性粒細胞之後,對肝缺血/再灌注(ischemia/reperfusion,I/R)損傷具有治療作用[22]。除此之外,MSC-EVs可以釋放micro-RNA(miR)-133b、miR-184、miR-210或miR-17-92,以促進神經發生和血管生成,改善軸突或樹突形成和神經突觸重塑,並抑制腦缺血性大鼠神經元的凋亡[23]。EV是一類新興的藥物遞送天然載體,在卒中模型小鼠中注射負荷線粒體的EV,可通過提高腦內皮細胞存活率保護血腦屏障(blood brain barrier,BBB),並減少大腦梗死面積[24]。小鼠短暫性局灶性腦缺血時,EV在AST和神經元之間的線粒體跨細胞轉移也被證明依賴於NAD+/CD38/環腺苷二磷酸核糖(cADPR)/Ca2+,CD38是一種Ⅱ型跨膜糖蛋白,可催化cADPR的合成與降解,其傳導的激活強烈地誘導了線粒體蛋白質的O-GlcNA糖基化修飾,支持AST釋放的線粒體的功能,小干擾RNA(small interfering RNA,siRNA)抑制CD38表達後,EV的量顯著減少,並加劇了神經系統的損害[25]。
線粒體除了在EV中被排出外,還具有產生自己的囊泡的能力,稱為線粒體衍生囊泡(mitochondria-derived vesicle,MDV),以便將線粒體蛋白和脂質運輸到細胞內的其他細胞器[26]。MDV是除了線粒體蛋白酶、泛素介導的蛋白酶體降解和線粒體自噬作用之外的新型線粒體質量控制手段。
1.3 GJ GJ是連接蛋白的跨膜複合物,允許細胞間通訊,其中離子和小信號分子可以在相鄰細胞之間轉移[9]。線粒體通過GJ內化在細胞之間轉移,這個過程中,兩個相連細胞中的一個細胞會吞噬GJ,然後占據相鄰細胞的細胞膜和細胞質,最終形成雙膜囊泡,通常稱該囊泡為連接小體或環狀間隙連接[27]。
Cx43是線粒體通過GJ轉移所必需的,已被證明在某些情況下可以保護腦組織免受I/R損傷。線粒體從MSCs到受傷運動神經元的轉移是通過GJ發生的,減少了氧糖剝奪(OGD)誘導的細胞凋亡,促進神經元存活並改變脊髓前角運動神經元中細胞凋亡相關蛋白的表達。此外,研究顯示,MSCs和神經元之間可能形成Cx43和Cx32的異型間隙連接,其中Cx43在MSC中表達,但不在運動神經元中表達;同時,Cx32在運動神經元中表達,但不在MSC中表達[28]。
另有研究認為,編碼Cx43的基因GJA1,還可以在內部翻譯以產生長度為20 kD的肽,稱為間隙連接蛋白α1截短單體-20k(gap junction protein alpha 1 truncated monomer-20k,GJA1-20k)[29],GJA1-20k促進微管依賴性線粒體轉運並在細胞應激期間保持線粒體網絡的完整性[30]。且GJA1-20k上調AST中功能性Cx43表達,促進線粒體從AST向神經元的傳遞[31],缺乏GJA1-20k會加速Cx43蛋白降解,抑制線粒體的轉移[32]。鑑於GJA1-20k在心臟I/R損傷情況下的保護作用,GJA1-20k可能在大腦I/R損傷中也具有治療潛力。
1.4 通過其他途徑進行線粒體轉移:細胞融合和線粒體擠出 如上所述,線粒體從供體細胞轉移到受體細胞在大多數情況下依賴於TNT、EV和GJ。然而,一些研究也報導,通過細胞融合和線粒體擠出也可進行線粒體轉移。細胞融合可導致兩個細胞之間共享胞質內容物和細胞器,但細胞核保持完整。基於一種仙台病毒包膜的方法,WADA等[33]證明可以讓兩個分離的細胞通過狹窄的細胞質連接融合,隨後,其可以調控細胞質連接的距離,以實現單個線粒體轉移速率的定量控制。通過部分細胞融合和線粒體轉移,MSCs可以將成年小鼠心肌細胞重新編程為恢復活力的祖細胞樣狀態[34]。來自骨髓和淋巴譜系的細胞可以低速率與不同的組織融合,以響應損傷或炎症[35]。細胞融合可以改變所涉及的細胞的潛力,對再生和癌症具有重要意義。
線粒體擠出是細胞之間線粒體轉移的另一種可能機制,主要作為線粒體質量控制的一種發生手段或危險信號轉導。在腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)誘導的壞死性凋亡細胞中,細胞質液泡包圍線粒體,與質膜融合,將游離線粒體釋放到細胞外培養基。因為肌動蛋白或微管蛋白的不穩定抑制了細胞質液泡的形成,所以完整的肌動蛋白和微管蛋白細胞骨架也是膜起泡和線粒體擠出所必需的。研究發現,從應激細胞擠出的游離線粒體是引發炎症反應的特殊危險信號之一[36]。BOUDREAU等[37]揭示了活化的血小板可以釋放功能性線粒體,將功能性線粒體由靜脈注射到小鼠體內可促使中性粒細胞黏附在血管壁上,導致中性粒細胞的激活和炎症反應。
神經元和AST之間的線粒體轉移主要機制如圖1。
2 線粒體轉移在PSCI中的作用
2.1 增加神經元活力 缺血誘導的糖氧剝奪在受影響區域導致ATP產生降低,線粒體ROS過度釋放,線粒體膜上的離子不平衡,最終導致程序性細胞死亡[3],從而導致海馬神經元在腦I/R後嚴重受損,認知受到影響。線粒體從AST轉移到神經元已被證明可以增加神經元存活率,恢復神經元線粒體膜電位,提高ATP水平,使神經元鈣動力學正常化,並增加體外樹突長度[38]。
在壓力條件下,神經元的線粒體釋放也被認為是「求救」信號,有缺陷的線粒體被吸收後,導致AST的線粒體Miro 1表達增加,有助於健康線粒體從AST轉移到神經元[38]。此過程涉及CD38,位於內質網上的Sigma-1受體分子伴侶(sigma-1 receptor chaperone,Sig-1R)通過激活細胞外調節蛋白激酶1/2(sxtracellular signal regulated kinase1/2,ERK1/2)增強CD38的表達,從而促進AST線粒體轉移[39]。另外,線粒體融合蛋白2(mitofusin 2,Mfn2)與線粒體相關內質網膜(mitochondria associated endoplasmic reticulum membrane,MAM)形成有關,介導了骨細胞之間的線粒體轉移,且MAM在這方面可能具有未知的功能[40]。HAYAKAWA等[41]也證明了CD38信號傳導介導了活化的AST中功能性線粒體的釋放,恢復ATP水平和神經元活力。用局灶性腦缺血小鼠模型中培養的AST釋放的含有細胞外線粒體的顆粒進行治療,可對腦卒中小鼠提供神經保護。在體外,功能性線粒體可以通過TNT由MSC轉移到受損的內皮細胞,從而拯救線粒體有氧呼吸並保護內皮細胞免於凋亡,顯著提高受損微血管細胞的線粒體活性,減少梗死面積,利於血管再生,促進功能恢復[42]。
以上研究表明,體外MSC到神經元線粒體遞送和體內AST衍生線粒體轉移均可促進神經元存活,適當增強腦卒中後線粒體轉移有可能增強缺血區神經元活力並改善PSCI。
2.2 增強線粒體代謝 神經元能夠釋放受損的線粒體並轉移到AST中進行降解和接收,這種能力首先在小鼠視網膜神經節細胞軸突中觀察到,其通過在與相鄰AST直接接觸時產生突起來擠出受損的線粒體,轉移到AST後,線粒體通過傳遞自噬的過程中降解[43]。線粒體對於突觸功能和神經遞質的合成、釋放和攝取至關重要[44]。損傷線粒體的累積可能導致神經損傷和突觸功能障礙,突觸缺失與認知缺陷和運動功能障礙密切相關[45-46]。
神經元和AST之間形成了TNT樣結構,並首次發現人類AST對神經元線粒體的內化和降解增加,且S100鈣結合蛋白A4(s100 calcium binding protein A4,S100A4)可能參與此過程的線粒體轉移[47]。Rhes蛋白是大腦線粒體自噬的關鍵調節因子,已被證明通過TNT在紋狀體神經元之間轉移,並與受體細胞中受損的線粒體結合,這表明神經元也可能轉移線粒體自噬增強蛋白以幫助傳遞自噬過程[48]。在短暫的大腦中動脈缺血(middle cerebral artery occlusion,MCAO)大鼠中給予自噬誘導劑西羅莫司可激活線粒體自噬,從而減輕線粒體功能障礙並改善神經系統結局。有趣的是,線粒體自噬在卒中的情況下也可能產生負面影響,其可能會引起線粒體不受控制的降解,從而導致細胞死亡[49]。反之抑制線粒體鈣離子單向轉運蛋白(mitochondrial calcium uniporter,MCU)可有效遏制過度線粒體自噬,保護神經元免受I/R損傷[50]。
線粒體轉移也被認為能夠幫助細胞清除致病物質。例如,暴露於α-突觸核蛋白(α-synuclein,α-syn)的小膠質細胞,已被證明可以通過TNT將線粒體和α-syn轉移到鄰近的健康小膠質細胞,其中α-syn被有效降解[51]。受損細胞將損傷線粒體轉移到健康細胞中進行內吞和降解,從而實現線粒體的循環[52]。綜上所述,這些發現強調了細胞間線粒體轉移可以通過降解受損線粒體,確保海馬神經元和突觸的線粒體完整性,從而為治療PSCI提供新的治療靶點。
2.3 調控神經炎症 缺血性神經炎症是影響缺血性卒中發展和預後的重要病理標誌[53]。一旦啟動炎症級聯反應,就會加重神經元功能障礙,誘導BBB破裂,產生腦水腫,最終導致神經元死亡[54]。外源性線粒體移植可以有效地驅動小膠質細胞表型轉化,進而改善炎症反應,進一步改善認知障礙[51,55]。
神經炎症過程的啟動主要發生在半影區域,可歸因於缺血核心壞死細胞釋放細胞內容物和促炎分子。這些炎症觸發因素引起線粒體鈣離子攝取增加、線粒體膜通透性轉換孔(mitochondrial permeability transition pore,mPTP)開放和線粒體ROS過度產生,特別是在腦缺血時,線粒體mPTP的開放釋放損傷相關的分子模式(damage associated molecular patterns,DAMPs),如ATP、ROS、心磷脂和mtDNA,參與NOD樣受體熱蛋白結構域相關蛋白3(NOD-like receptor thermoprotein domain 3,NLRP3)的啟動和激活,導致神經炎症和細胞焦亡[56]。整個線粒體也可以從受損細胞中釋放出來,並充當特殊的DAMPs,通過血紅素氧化酶1(heme oxygenase-1,HO-1)信號通路被MSC吞噬和降解,隨後刺激MSC中的線粒體生物發生[57]。通過HO-1通路維持BBB的完整性,線粒體生物發生為細胞供給許多再生線粒體,均可緩解PSCI。由於受損的線粒體在促炎信號傳導中起關鍵作用,因此通過MSC療法修複線粒體功能可以隔離炎症並促進中樞神經系統穩態。MSC在卒中的假定治療作用可能涉及通過健康線粒體轉移到缺血大腦受損細胞中進行功能修復,從而減少有害炎症遞質的釋放,抑制繼發性細胞死亡,維持腦血管正常功能[58]。WEBB等[59]證明,在小鼠卒中模型中用NSC-EVs治療可顯著減少神經損傷,對運動功能、記憶形成和慢性炎症也有積極影響。
體外研究發現,AST釋放的線粒體似乎對小膠質細胞發揮抗炎作用,因為小膠質細胞通過攝取其釋放線粒體增加了人蛋白(humanin,HN)水平,這與過氧化物酶體增殖物激活的受體γ(peroxisome proliferator activated receptor γ,PPARγ)及含錳超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)水平升高有關,這兩者均可促進小膠質細胞向抗炎修復性表型轉化[60]。然而,與AST線粒體轉移不同,活化小膠質細胞通過功能失調的線粒體轉移將炎症信號傳播到AST,從而觸發受體AST的促炎A1激活狀態。這些小膠質細胞激活的AST反過來將碎片化的線粒體釋放到細胞外空間,通過抑制ATP產生和線粒體膜電位來觸發神經元損傷[61]。以上研究表明線粒體轉移可以減輕神經炎症,因此可能減輕腦血管疾病引起的認知障礙。
3 靶向線粒體移植治療PSCI
缺血性腦卒中後,缺乏葡萄糖和氧氣供應會干擾線粒體中的ATP合成,導致能量失衡,細胞穩態失調,最終導致海馬神經元大量死亡,進而引起認知功能障礙。因此,靶向線粒體是一種有前途的腦卒中後神經保護方法。
然而這種內源性機制在很大程度不能限制腦缺血後神經元的退化,需要外源性線粒體移植治療進行干預(表1)。線粒體移植已被證明在一系列條件下發揮神經保護作用並改善疾病嚴重程度。鼻內給予線粒體可緩解小鼠內側前額葉皮質腦卒中光血栓模型中的認知障礙和線粒體功能障礙[62]。一項腦缺血模型(MCAO)大鼠模型的隨訪研究表明,受損腦微血管系統接受了從移植MSC轉移的線粒體之後,其線粒體活性明顯提高,血管生成增強,腦梗死體積減小,並且神經功能也得到了改善[42]。研究表明,AST線粒體移植能夠調節腦出血後神經元抗氧化防禦和神經可塑性,促進神經元的功能恢復[63]。除此之外,AST在外源性線粒體的作用下可增強腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)的表達,PSCI與海馬體中的BDNF密切相關,BDNF有利於增強海馬突觸可塑性、神經發生和神經元存活[64]。同時,自體線粒體移植已被證明可以減少細胞氧化應激和細胞凋亡,並改善缺血性腦卒中後的神經發生[65]。其他腦疾病,例如在精神分裂症的動物模型中發現,在大鼠前額葉皮質內注射分離的正常線粒體可防止其注意力降低[66]。

不同細胞來源的線粒體均可產生治療作用。事實上,AST或MSC可能作為線粒體分離的供體細胞。分離的異源線粒體移植已被證明可以減小缺血性卒中大鼠模型中的梗死面積並改善行為結果[67]。且正如大量動物和臨床研究顯示,MSC移植正在成為緩解神經功能障礙的一種有前途的治療方法。此外,源自MSC的EV也促進了卒中後恢復,其具有調節受體細胞基因表達的能力,改變缺血性卒中所涉及的細胞特性,並促進各種分子轉移。通過抑制EV的釋放,其產生的有益效果也被抑制[68-69]。在MSC與人外周血單個核細胞(PBMC)的共培養實驗中,當以增加的MSC∶PBMC比率培養供體MSC時,觀察到線粒體轉移呈劑量依賴性曲線[70]。進一步體內研究,通過用新鮮的人分離線粒體靜脈內治療阿爾茨海默病(AD)小鼠,有利於治療AD缺陷,線粒體移植後14 d,接受外源性線粒體治療的AD小鼠的認知能力顯著提高,改善了腦病理學和線粒體缺陷[71]。線粒體的其他來源可能是內皮祖細胞(endothelial progenitor cells,EPC),EPC衍生的細胞外線粒體可以轉移到腦內皮細胞,並恢復線粒體功能,修復破壞的BBB。增強細胞間線粒體轉移或許是改善神經系統疾病線粒體功能障礙的有效措施。
最後,目前調查人工線粒體移植在大腦中的治療效果的研究僅限於臨床試驗前的動物研究,因此需要更多深層次的研究來證明該方法對人類患者的安全性和有效性。但以上研究結果可以表明,線粒體轉移到缺血性神經元有助於腦卒中的治療,線粒體移植可能是改善PSCI的潛在治療策略。
4 小結與展望
人工線粒體移植已被證明在腦損傷、神經退行性疾病和神經發育障礙的臨床前動物模型中具有神經保護作用。如前所述,神經膠質細胞和大腦神經元間的線粒體轉移可以增強神經元活力、幫助功能障礙的線粒體降解和調控神經炎症等。然而,線粒體轉移/移植是否影響受體細胞的線粒體穩態尚未在文獻中明確描述,應更加關注線粒體的數量和質量及其對移植過程中線粒體穩態的影響。
線粒體功能障礙是腦缺血發病機制的早期重要因素之一,恢復線粒體的功能和拯救受損線粒體,對於治療缺血性腦損傷具有至關重要的作用,細胞間線粒體轉移可能是治療PSCI的有效靶標。通過加速神經元釋放或AST吞噬來促進細胞間線粒體轉移,可作為未來治療缺血性腦卒中的潛在治療策略。然而很少有研究將線粒體轉移與PSCI直接聯繫,需要進一步的研究來闡述這一過程在腦卒中患者中的安全性、有效性。在未來幾年,研究人員應專注於線粒體轉移治療PSCI的潛在治療應用,並探索基於線粒體的療法,以發揮其最大潛力。
本文無利益衝突。
參考文獻略
本文來源:肖雨倩,白艷傑,王岩,等. 線粒體轉移在腦卒中後認知障礙中的研究進展[J]. 中國全科醫學, 2023, 26(30): 3833-3840. DOI: 10.12114/j.issn.1007-9572.2023.0162.(點擊文題查看原文)