郭治彬 教授 南昌大學第一附屬醫院心內科主任醫師、碩士生導師
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)可能是第一個基於病因與發病機制進行精準治療的心血管病,越來越受到心血管專科醫師的重視。
1、 定義:
HCM主要是由於編碼肌小節相關蛋白基因致病性變異導致的、或病因不明的以心肌肥厚為特徵的心肌病,左心室壁受累常見,需排除其他的心血管疾病或全身性、代謝性疾病引起的心室壁增厚。超聲心動圖或者磁共振檢查左心室舒張末期任意部位室壁厚度≥ 15 mm可確診,致病基因檢測陽性者或者遺傳受累家系成員檢查發現左心室壁厚度≥ 13 mm 也可確診 。
2、分型:
HCM 可根據血流動力學、遺傳學特點或者肥厚累及的部位三種方法進行分型。
(1)根據血流動力學特點分型: 這種分型有利於指導患者治療方案的選擇,是目前臨床最常用的分型方法。
1)梗阻性 HCM:
異常肥厚心肌突入左心室腔,造成血流通道阻塞,並在其上下方產生左心室 流出道壓力階差(LVOTG)。根據LVOTG的變化情況分為靜息梗阻性和隱匿梗阻性,前者指靜息時 LVOTG 峰值 ≥ 30 mmHg(1 mmHg=0.133 kPa),後者指靜息時 LVOTG 峰值。心肌肥厚累及右心室時,靜息時右心室流 出道壓力階差峰值≥ 16 mmHg 診斷為右心室流出道梗阻。
2)非梗阻性 HCM:靜息時或激發後 LVOTG 峰值均< 30 mmHg。
(2)根據遺傳學特點分型:為家族性HCM和散發性HCM。家族性 HCM 是指除先證者外,三代直系親屬中有一個或以上成 員被確診為 HCM,或存在與先證者相同的基因變異,伴或不伴有心電圖及超聲心動圖異常。否則為散發 性 HCM。
(3)根據心肌肥厚部位分型:
1)心室間隔肥厚:臨床最常見,主要累及室 間隔基底部。部分累及室間隔中部,表現為左心室 中部乳頭肌水平的室間隔肥厚。
2)心尖部肥厚:主要累及左心室乳頭肌水平 以下心尖部,通常不伴 LVOTG 升高。
3)左心室壁瀰漫性肥厚:少數患者表現為左 心室壁瀰漫性增厚。
4)雙心室壁肥厚:除左心室壁肥厚外,還有 右心室壁肥厚(右心室游離壁厚度 >5 mm)
5)孤立性乳頭肌肥厚:主要特點是乳頭肌肥 厚,其餘左心室節段不受影響 [5] 。
3、病因:
基因變異是絕大多數 HCM 患者的根本病因,約60%的HCM患者可以找到明確的致病基因變異。HCM 的主要病因是編碼肌小節蛋白或肌小節相關結構蛋白的基因變異,主要表現為常染色體顯性遺傳,約 60% 的 HCM 存在致病性或可能致病性基因變異,仍有大約 40% 的 HCM 未找到明確致病基因。
肌小節是心肌纖維的基本單位,其成分包括粗肌絲、細肌絲、Z 線、M線等。編碼粗肌絲相關的β肌球蛋白重鏈基因(MYH7)和心臟型肌球蛋白結合蛋白C基因(MYBPC3)是HCM最主要的致病基因,約各占HCM 的 15%~30%,目前已證實的基因變異超過2 000餘種。
4、發病機制:
基因變異可以通過改變胺基酸序列,即顯性負效應(毒肽效應),產生具有生物學功能缺陷的蛋白;也可以通過降低編碼蛋白的表達水平(單倍型劑量不足),使正常蛋白合成不足,最終造成肌小節或肌小節相關蛋白結構或功能異常,如 Ca 2+ 敏感性增加、ATP 酶活性異常、肌球-肌動蛋白相互作用或肌小節裝配發生改變等,使得心肌收縮異常、舒張功能受損、能量消耗增加,進而引起心肌壓力感受及應答通路異常,誘發心肌細胞的組織學和形態學變化,導致心肌細胞肥大、排列紊亂、間質纖維化、 心肌重塑等。
雖然 HCM 被傳統觀點認為是單基因疾病,但是,HCM 的最終臨床表型是基因型、修飾因子以及環境條件等多種因素共同作用的結果。相同的基因變異因個體的基因表現度和外顯率不同,以及遺傳背景、表觀修飾、生活方式或其他暴露因素的差異可呈現不同的臨床表型。部分 HCM 病因及發病機制尚不明確,對其相關的探索仍在不斷進行之中。
5、 診斷
(1)臨床表現
臨床症狀變異性大,有些患者可長期無症狀,而有些患者首發症狀就是猝死。兒童或青少年 時期確診的 HCM 患者症狀更多,預後可能更差。常見症狀:呼吸困難、胸痛、頭暈、心悸、暈厥、猝死, HCM 的心衰以射血分數保留的心衰(HFpEF)為主,主要由心室舒張功能異常引起。
(2)診斷方法:
1)實驗室檢查: B型利鈉肽或NTproBNP、血清心肌肌鈣蛋白不同水平升高,
2)常規心電圖:HCM 患者心電圖可表現有 ST-T 改變及異常Q波。
3)負荷試驗: 負荷試驗可用於評估左心室流出道是否存在隱匿性梗阻,或評估運動或心肺貯備功能,用以指導疾病的遠期管理和治療。
4)心臟磁共振成像(CMR): CMR 除了能夠準確顯示心臟 結構與功能變化外,還可以結合釓對比劑延遲強化(LGE)在體識別心肌纖維化。
LGE 是目前臨床在體評估心肌纖維化最有效的方法,約有65%的HCM患者會出現 LGE,多表現為肥厚心肌內局灶性或斑片狀強化,其中以室間隔與右心室游離壁交界處局灶狀強化最典型。室間隔非對稱性肥厚伴右心室插入部強化以及繼發性左心房擴大是 HCM 最常見徵象。
LGE 在疾病預後判斷和危險分層中發揮重要作用,出現廣泛 LGE(LGE 定量≥左心室質量的 15% 或目測 LGE 分布廣泛)提示 SCD 風險增加 。
5)放射性核素顯像: 放射性核素顯像在HCM診斷中可用於以下情況: ( 1)心肌缺血和冠狀動脈微循環功能障礙的鑑別;( 2)心臟澱粉樣變的鑑別。
6)計算機斷層血管成像 / 造影: 對於有心絞痛或存在心肌缺血證據的 HCM患者,建議行冠狀動脈計算機斷層血管成像/冠狀動脈造影用以排除是否存在缺血性心臟疾病。對於需要行減容術的HCM患者,推薦冠狀動脈造影檢查用以評估冠狀動脈的解剖和狹窄情況。
7)左心室造影:左心室造影檢查不僅可通過造影顯示心臟和血管的形態結構,還可測量心腔內的壓力。存在左心室流出道梗阻時,左心室造影可見心室腔與流出道之間存在收縮期壓力階差。左心室造影可以幫助判斷特殊類型 HCM,如心尖肥厚患者心腔呈典型的「黑桃 A」形態。
8)心內膜心肌活檢:
心內膜心肌活檢病理檢查有助於診斷或鑑別診斷疑似的代謝性或系統性疾病心肌受累。
HCM 的病理特徵:HCM 以左心室和(或)右心室壁肥厚、尤其是室間隔的非對稱性肥厚為特徵。心臟澱粉樣變常在心肌間質、 心肌細胞周圍和血管壁沉積,剛果紅染色陽性,偏振光顯微鏡檢查可見特徵性的「雙摺光」。心肌活檢是澱粉樣變的確診手段和分型的基礎(免疫組織化學染色,顯微切割與質譜分析)。
法布雷病心肌病理特徵:可見顯著的空泡變性,電鏡檢查可見大量電子 緻密的同心性層狀小體即髓鞘樣小體。
龐貝病心肌病理特徵:可出現不同程度的空泡變性,過碘酸雪夫染色陽性, 電鏡下可見大量膜包繞的糖原小體。
Danon病心肌病理特徵:心肌細胞內可見嗜鹼性顆粒,可以被非特異性酯酶和乙 醯膽鹼酯酶染色,過碘酸雪夫染色陽性,電鏡檢查 可見自噬體堆積,2型溶酶體相關膜蛋白免疫組織化學染色可完全缺失。線粒體疾病可有酶組織化學改變,電鏡下可見線粒體增生和巨大線粒體或線粒體包涵體 。
9)基因診斷:
目前認為HCM主要是由罕見變異通過常染色體顯性遺傳模式導致的疾病,偶有隱性遺傳模式報導。已經報導與 HCM 相關的基因眾多(表 1),但證據充分的明確致病基因主要為編碼肌小節蛋白的基因,包括MYH7、MYBPC3、TNNT2、TNNI3、 MYL2、MYL3、TPM1 和 ACTC1,這些基因的變異可以解釋超過90% 的遺傳陽性HCM,因此,HCM 也被稱為「肌小節疾病」。其中以MYH7和MYBPC3基因變異所占比例尤多,約占所有肌小節變異患者的 80%~90%。
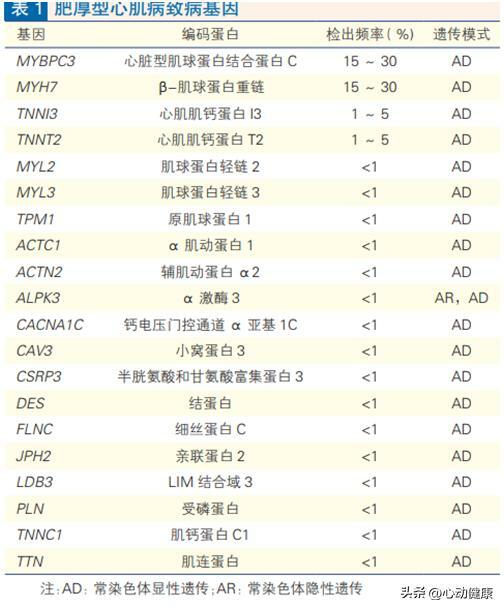
HCM致病基因的外顯率(即致病變異攜帶者最終發生HCM 的比率)為 40%~100%, HCM 基因診斷流程見圖1。
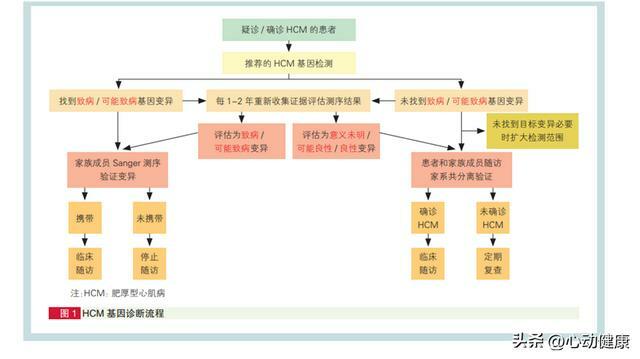
(3)先證者的遺傳諮詢:
家族中第一個確診為 HCM 的患者稱為「先證者」。無論是否行進一步臨床診療或基因篩查,推薦所有HCM患者進行遺傳諮詢,分別從醫學、遺傳學、 心理學、倫理學、法律等多個角度與患者進行溝通和提供諮詢意見。通過遺傳諮詢,也能更好地收集其他家庭成員 的相關信息,進而完善家系圖譜,並為下一步的病因學檢測提供證據和線索。
6、鑑別診斷:
臨床上引起心肌肥厚的原因多樣,對於出現心肌肥厚的代謝性或者系統性疾病的患者,在治療上與 HCM 存在本質區別。因此,需予以系統的鑑別診斷,優化患者的管理。
1)高血壓導致的心肌肥厚:患者多有長期的高血壓病史,心肌肥厚通常呈對稱性,超聲顯示肥厚心肌為均勻的低回聲,一般室壁厚度≤ 15 mm,室間 隔與左心室游離壁的厚度比多小於 1.3。經嚴格血壓 控制 6~12 個月後,左心室壁肥厚程度一般可減輕或者消退。
2)主動脈瓣狹窄和先天性主動脈瓣下隔膜: 主動脈瓣狹窄中 20% ~30%合併不對稱性心肌肥厚,心肌肥厚的程度通常相對較輕(室壁厚度 ≤ 15 mm),主動脈瓣狹窄程度常為中度以上,而 HCM患者一般無明顯的主動脈瓣病變。超聲心動圖 可明確病變。先天性主動脈瓣下隔膜也常合併心肌肥厚,但心肌肥厚主要表現為對稱性,超聲心動圖 和 CMR 檢查見瓣下隔膜可確診。
3)冠心病:冠心病患者年齡多在40歲以上,有高血壓、高脂血症等相關危險因素,可並發左心室壁或室間隔肥厚和左心室舒張功能受損。但冠心病患者R波電壓一般不高,超聲心動圖通常不出現明顯的非對稱性左心室壁肥厚、左心室流出道梗阻或 SAM征。冠狀動脈造影及HCM基因檢測可協助診斷。
4)運動員: 運動可誘發生理性心肌肥厚,心電圖上可有高電壓、早期復極、非特異性 ST-T 改變等,但一般無 HCM 家族史、心肺運動功能較好,超聲心動圖可顯示左心室壁輕度均勻增厚(非對稱性心肌肥 厚或者心尖肥厚罕見),可合併左心室腔內徑增大,但通常不合併左心房增大和嚴重的左心室舒張功能異常,CMR 顯示無明顯心肌纖維化,終止體能訓練可使肥厚程度減輕。
5)內分泌異常: 肢端肥大症時由於生長激素和胰島素樣生長因 子 -1 分泌過多,會刺激肌小節蛋白合成從而導致心肌肥厚,通常為左心室壁均勻肥厚伴有心腔擴張,且較早出現嚴重的收縮功能障礙,檢測生長激素及生長因子水平可以鑑別。
糖尿病導致的心肌病是糖尿病 患者的一種特殊心臟表現,早期可表現為左心室壁 肥厚和舒張功能障礙,並可發展為收縮功能降低和心衰 。
在部分甲狀腺功能減退相關的心肌病患者中,可表現有室間隔的不對稱性肥厚,並可在早期規範的甲狀腺激素替代治療後恢復。
6)藥物因素: 長期使用一些藥物,包括羥氯喹、他克莫司和 促蛋白合成類固醇等,可以導致左心室壁肥厚,但室壁厚度很少會超過 15 mm,大部分患者左心室壁肥 厚可在停藥後逆轉 。
7)澱粉樣變: 澱粉樣變是由遺傳、變性和感染等因素引起蛋白前體形成不可溶性澱粉樣纖維並沉積於器官或組織細胞外,導致其結構和功能障礙的一組疾病,其中心臟是澱粉樣變常累及的器官,表現為心肌肥厚和舒張功能受損。
與 HCM不同,澱粉樣變導致的左心室壁肥厚通常為對稱性,大多數不伴有左心室流出道梗阻, 心電圖表現為低電壓或者正常電壓。除心室肌外, 房間隔和瓣膜也可以由於澱粉樣物質沉積發生增厚。CMR 成像顯示 LGE 多發生在心內膜下,可以 延展至附近心肌,而 HCM 時 LGE 則多見於明顯增厚的室壁處的中層。99 Tc m 標記的磷酸鹽衍生物 對於診斷轉甲狀腺素蛋白澱粉樣變心肌病有較好的特異度和靈敏度。
澱粉樣變常有心臟外表現,如周圍神經病變、腹瀉或者假性腸梗阻、尿蛋白或腎功能不全、玻璃體混濁和雙側腕管綜合徵等。老年人新發的左心室壁肥厚、特別是合併有心電圖低電壓表現、房室阻滯、主動脈瓣中重度狹窄和心臟外器官受累等情況時,有 11%~16% 是由轉甲狀腺素蛋白澱粉樣變所致。
8)法布雷病: 法布雷病是一種X連鎖遺傳的溶酶體貯積病,編碼 α-半乳糖苷酶A的GLA 基因變異引起該酶活性降低或缺失,以致其降解底物——神經鞘脂類 化合物及衍生物在心臟等全身多個器官組織細胞中貯積,引起相應多臟器病變,如外周神經疼痛、少汗、皮膚血管角化瘤、蛋白尿、腎功能不全、眼部及心臟病變等。經典型多於兒童期發病,遲髮型多為成年後發病,往往男性(半合子)臨床表現及分型重於女性(雜合子)。
心臟受累多表現為向心性心肌肥厚,由於神經鞘脂類物質主要沉積在內膜下而肌層受累較輕,超聲心動圖可見內膜和外膜回聲強而中間肌層回聲弱的「雙邊」表現。
心電圖常 表現為傳導系統受累,短 PR 間期不伴預激綜合徵, QRS 時限延長,右束支阻滯,此外 aVL 導聯 R 波電壓≥ 1.1 mV 及下壁導聯ST段壓低對該病診斷有提 示作用。CMR成像初始T1值較HCM有顯著降低,T2值增高,LGE通常出現在左心室下側壁基底部,在心肌內正中分布,心內膜和心外膜下常不受累。
心肌活檢可見心肌細胞肥大,胞漿內空泡變,過碘酸雪夫染色陽性,電鏡下胞漿內可見典型的嗜鋨性 「髓樣小體」。需結合 α-半乳糖苷酶A活性、底物及衍生物水平等多項指標檢測以及基因檢測而明確診斷。
9)糖原貯積病: 糖原貯積病是一組因基因變異導致一種或多種參與糖原合成/降解的酶活性降低或缺乏的遺傳病,其特徵是組織中糖原沉積或糖原結構異常。該病的鑑別要點主要是多系統受累的臨床表現,嚴重的左心室壁肥厚,早期進展為擴張相,常伴心室預激和傳導異常等心電圖表現,心肌活檢可見心肌畸形肥大排列,多有心臟增大、猝死家族史。
10)Danon 病:系編碼2型溶酶體相關膜蛋白的基因變異導致的X連鎖顯性遺傳病。臨床主要表 現為骨骼肌病、智力發育遲緩和心肌病變。心肌肥厚的患者中 0.7%~2.7% 經基因檢測診斷為該病。男性主要表現為嚴重的左心室對稱性肥厚,而女性 多為非對稱性肥厚,室壁厚度常達 30 mm 以上。心電圖左心室高電壓明顯,80% 以上患者合併預激綜合徵。CMR 成像LGE分布廣泛、形式多樣,但以不累及室間隔中段為特徵性表現。心肌或骨骼 肌活檢可見特徵性自噬空泡改變,血清肌酸激酶明顯升高提示該病,基因檢測有助於診斷。
11)單磷酸腺苷激活蛋白激酶 γ2 亞基編碼基因變異心臟綜合徵:系由該基因變異導致的常染色體顯性遺傳病。臨床主要表現為左心室壁肥厚、預激綜合徵和逐漸進展的傳導系統疾病。大部分患者無心臟外表現,少數可有骨骼肌異常,通常不伴左心室流出 道梗阻和SAM征;利用超聲心動圖斑點追蹤技術可見「條帶樣」特異性改變 。 基因檢測有助於明確診斷。
12)線粒體疾病: 線粒體疾病是因線粒體DNA或細胞核 DNA缺陷,引起細胞氧化磷酸化功能失調,導致多系統病變的一種遺傳疾病。患者可在任何年齡起病,以對能量代謝需求較高的眼、腦、骨骼肌和心臟受累最為常見。心臟病變見於40%的患者,其中心肌肥厚最常見。早期多表現為左心室壁肥厚,之後逐漸出現心臟擴大、LVEF 降低、傳導阻滯或心室預激。
除心臟受累外,患者通常伴有其他系統受累,包括神經肌肉病變、內分泌、消化系統或腎臟等。實驗室檢查血乳酸、丙酮酸最小運動量試驗陽性;肌肉 及心肌活檢是指導診斷的有利證據,心肌活檢電鏡 示細胞內大量巨大的異常線粒體聚集,線粒體嵴增 多且排列紊亂,細胞色素氧化酶 / 琥珀酸脫氫酶免 疫組化雙重染色可見由於部分肌纖維細胞色素氧化 酶缺陷所導致的「馬賽克」樣變化;基因檢測發現核 DNA 或線粒體 DNA 變異等有助於診斷。
13)Friedreich 共濟失調: Friedreich 共濟失調是一種由FXN基因第一內含子(GAA)n 發生異常擴增、基因缺失或點突變所 致常染色體隱性遺傳病。患者多在青春期前後起 病,臨床主要表現為進行性步態和肢體共濟失調、 構音障礙、腱反射消失、病理征陽性和骨骼異常。 34%~77% 的患者伴有心肌肥厚。主要為左心室向心性肥厚,心電圖顯示有 T 波倒置、電軸左偏和復極異常。疾病晚期可出現左心室增大和收縮功能減低, 心衰和心律失常是死亡的主要原因。基因檢測有助於診斷。
14)血色病: 血色病是一類由過多鐵質沉積在組織器官而 引起不同程度的基質細胞破壞、纖維組織增生及功能障礙的疾病。原發性血色病主要由HFE、 HFE2、HAMP、TFR2、SCL40A1 等基因變異導致 先天性鐵代謝障礙;而繼發性則多見於大量輸血、 長期內服鐵劑、慢性酒癖並攝入含鐵飲食所致。患者常有鐵沉積的系統性損害,如全身皮膚色素沉著、 糖尿病及肝硬化等表現。患者早期即可出現左心室壁增厚和心臟舒張功能異常,心電圖可有肢體導聯低電壓,各種心律失常(房性及室上性心律失常多見, 房室阻滯和室性快速型心律失常較少見),晚期 常進展至左心室擴張和收縮功能改變。轉鐵蛋白飽和度(> 60%)、肝臟和心臟影像學提示鐵負 荷過度,肝穿刺/心肌活檢和基因檢測有助於明確診斷。
15)畸形綜合徵: 畸形綜合徵主要是指絲裂原活化蛋白激酶途徑基因變異引起的遺傳性疾病,每1 000到2 500名兒童中就有1人受到影響。絲裂原活化蛋白激酶信號通路有 15 個以上的基因編碼,對細胞周期至關重要,在增殖、分化、生長和代謝中具有調節作用, 會導致一系列疾病包括 Noonan 綜合徵、豹斑綜合徵、 Costello 綜合徵、心麵皮膚綜合徵。這些畸形綜合徵可合併心肌肥厚表現,需要與HCM進行鑑別,鑑別要點在於是否合併心臟外畸形和異常,基因檢測發現絲裂原活化蛋白激酶信號通路相關的基因變異有助於診斷。
7、診斷流程:
臨床診斷 HCM 應基於以下因素:HCM 家族史、 不明原因的症狀(如呼吸困難、胸痛、乏力、心悸、 暈厥或先兆暈厥)、收縮期噴射性雜音和心電圖異 常,有上述一個或多個臨床發現時,應進一步行超 聲心動圖和(或)CMR 檢查等以確定診斷,需排除 其他明確的心原性、系統性或代謝性疾病導致的心肌肥厚。診斷流程如下圖 。
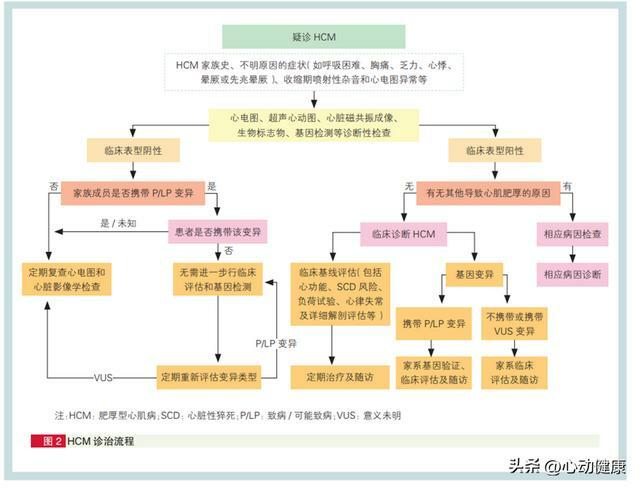
成人 HCM 的臨床診斷標準為二維超聲心動圖或 CMR 測量的左心室舒張末任意節段室壁厚度 ≥ 15 mm,且無其他已知的可引起心肌肥厚的病因。當患者室壁厚度為 13~14 mm,同時伴有 HCM 家族史或有基因檢測陽性結果時,也可診斷 HCM 。左 心室壁的任一節段都可能出現心肌肥厚,以前間隔基底段和前壁游離壁最易受累,部分人群肥厚部位非常局限,僅累及左心室 1~2 個節段,也有患者出現右心室壁肥厚。
8、心臟性猝死危險分層與防治
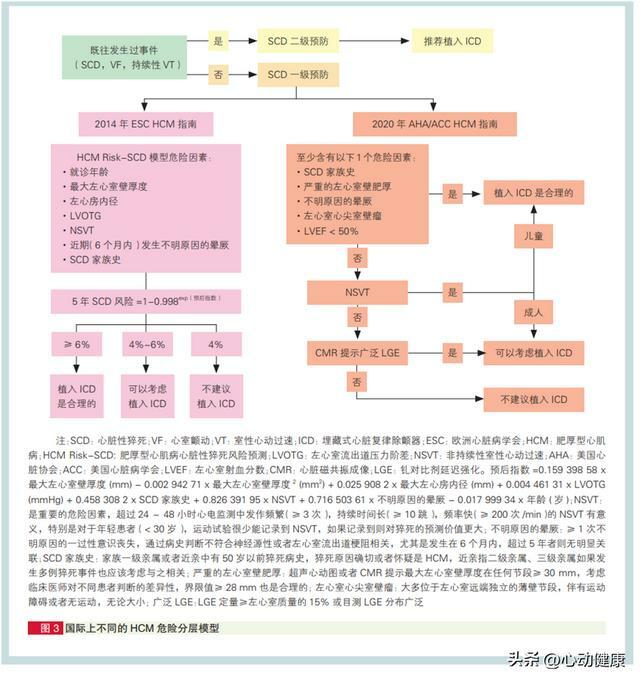
2020 年美國心臟協會(AHA)/ 美國心臟病學會(ACC)HCM 指南推薦根據患者有無下列危險因素評估 SCD 風險,並決定是否安裝 ICD(下圖 )。
9、治療:
HCM 治療的總體原則是減輕症狀,改善心功能, 延緩疾病進展。由於 HCM 發病機制主要是肌小節蛋白編碼基因變異,因此常規藥物很難從根本上解決心肌肥厚所導致的一系列臨床症候群。對非梗阻 性 HCM 患者的治療主要集中於控制心肌肥厚進展、降低左心室充盈壓力、減輕臨床症狀,及治療管理心律失常、心衰等合併症;對於梗阻性 HCM 患者, 可以通過藥物、介入治療、外科手術等來改善症狀,降低風險。
(1)非梗阻性 HCM 治療: 無症狀的非梗阻性 HCM 患者,大多數是查體或無意中被發現。如僅表現為局部心肌肥厚,沒有 明顯血流動力學改變,要啟動臨床觀察和隨訪(Ⅱ a, C),同時進行不良預後(如猝死)危險分層、合併症 評估,如無禁忌,可適當選用藥物治療(如 β 受體 阻滯劑等)。
合併心衰、心律失常等的非梗阻性 HCM 患者的治療方案與無 HCM 的心衰患者相似,應根據LVEF進行分層,在健康生活方式的基礎上,考慮合併疾病,進行個體化治療。合併房顫的非梗阻性 HCM 患者腦卒中風險增加,建議給予口服抗凝藥物 治療,無需CHA2DS2-VASc 評分,啟動抗凝治療前建議進行出血評分(Ⅰ,B)。由於 HCM 患者對 快速室率的耐受性較差,維持竇性心律和控制心率是治療的關鍵(Ⅰ,B)。
(2)梗阻性 HCM 治療: 與非梗阻性 HCM 患者相比,左心室流出道梗阻 的患者生存率較低,緩解梗阻可能有助於降低死亡:風險。
藥物治療: 梗阻性 HCM 藥物治療的主要目標是緩解症狀。
1) 梗阻性 HCM 患者,在無禁忌證情況下,根據心率、血壓情況,從小劑量開始使用 β 受體阻滯劑,逐步滴定至最大耐受劑量(Ⅰ,B)。除非在治療過程中有明顯 β 受體阻滯劑不耐受。
2)β 受體阻滯劑無效或不耐受的患者,可選用非二氫吡啶鈣拮抗劑(如維拉帕米、地爾硫草卓) (Ⅰ,B)。目前尚缺乏 β 受體阻滯劑與非二氫吡啶 鈣拮抗劑聯合使用治療 HCM 的證據,但這種聯合可用於HCM 合併高血壓的患者 。
3)對於使用 β 受體阻滯劑或非二氫吡啶鈣拮抗劑後仍有明顯症狀的患者,可聯用丙吡胺(Ⅰ,B)。 由於丙吡胺可增強房室結傳導,在房顫發作時有增加室率的可能,故建議應與 β 受體阻滯劑或非二氫吡啶鈣拮抗劑聯合使用。
4)梗阻性 HCM 患者易因左心室負荷變化發生 嚴重低血壓,如果補液效果不佳,建議靜脈注射苯腎上腺素或其他無正性肌力活性的血管收縮劑。β受體阻滯劑可以延長舒張期充盈、抑制心肌收縮力, 必要時可考慮聯合使用(Ⅰ,C)。
5)梗阻性 HCM 合併持續性呼吸困難的患者, 臨床證據顯示容量過載或左心室充盈壓高時,可考慮使用小劑量口服利尿劑(Ⅱ b,C),但過量利尿會降低前負荷而加重左心室流出道梗阻 。
6)梗阻性 HCM 患者,使用具有血管擴張作用的藥物如血管緊張素轉換酶抑制劑(ACEI/血管緊張素Ⅱ 受體拮抗劑(ARB)、 二氫吡啶鈣拮抗劑等,以及地高辛或大劑量利尿劑可能有害,原因與這些藥物加重流出道梗阻有關(Ⅲ,C)。
7)嚴重梗阻性 HCM 患者,靜息時 LVOTG >100 mmHg,出現靜息狀態嚴重的呼吸困難、低血 壓時,維拉帕米可能有害(Ⅲ,C)。這類藥物具有的血管擴張作用,使用後會加重低血壓及 LVOTG, 增加風險 。
8)靶向藥物治療:多中心臨床研究顯示 Mavacamten 可降低 LVOTG,改 善心功能和症狀 。因此,FDA 批准該藥可用於 NYHA 心功能分級Ⅱ ~ Ⅲ級且有症狀的成人梗阻性 HCM 患者。Aficamten(又稱 CK-274)是第二個進入臨床試 驗的小分子肌球蛋白抑制劑,相比 Mavacamten 其半衰期更短,可在2周內達到穩定濃度,治療窗相對更寬,Ⅲ期臨床試驗正在進行中。
9)介入治療: 臨床上主要包括經皮腔內室間隔心肌消融術 (PTSMA)、經皮心肌內室間隔射頻消融術(PIMSRA)和經皮心內膜室間隔射頻消融術(PESA)。
PTSMA 是通過導管將無水酒精注入左前降支的一支或多支間隔支中,造成相應肥厚部分的心肌梗死,使室間隔基底部變薄,以減輕 LVOTG 和梗阻的方法。
PIMSRA 是在超聲實時引導下,在心臟非停跳狀態下,將射頻針經皮膚、肋間、心尖精準穿刺直接送至室間隔心肌肥厚部位,利用射頻電極針前端發出的高頻交變電流,使肥厚心肌組織局部升溫、 心肌細胞脫水,造成不可逆凝固性壞死;同時,可使消融心肌內間隔支發生凝固形成反應帶,從而阻斷肥厚心肌組織血供,最終使室間隔厚度變薄、狹窄處內徑增寬,從而緩解梗阻。
PESA 是利用心腔內三維超聲導管同時將梗阻區和心臟關鍵傳導束直接描繪到電生理三維標測圖上, 最大限度地避免消融時傳導束的損傷。消融導管在梗阻室間隔區釋放射頻能量,使肥厚梗阻的室間隔短期內水腫,心肌頓抑,疤痕化後萎縮,隨後心肌向心性收縮力激動順序發生改變,這些綜合因素使 LVOTG 減低,緩解梗阻。該術式對梗阻性 HCM 伴暈厥者療效明確 。
10)外科手術治療
肥厚心肌切除外科手術的安全性已被證實,術後遠期生存率與年齡匹配的普通人群相近 。遠期效果良好的決定因素是年齡 < 50歲、左心房內徑< 46 mm、術前無房顫和男性患者。
11)植入雙腔起搏器: 起搏器的原理是使用短的 AV 間期改變了左心室的激動順序,遠離肥厚室間隔部位的心肌提前激動和收縮,而肥厚室間隔的激動和收縮相對滯後, 隨之減輕左心室流出道梗阻。對梗阻性 HCM 患者 植入起搏器需注意兩點:(1)心室起搏電極必須置於真正的右心室尖部。(2) 房室間期必須短於患者竇 性心律的 PR 間期。起搏治療的療效與選擇合適的房室間期有關。 對於部分靜息或激發時 LVOTG ≥ 50 mmHg、 竇性心律且藥物治療無效的患者,若合併介入治療 或外科手術治療禁忌證,或術後發生心臟傳導阻滯 風險較高,應考慮植入雙腔起搏器,通過房室順序 起搏並優化房室間期,以降低 LVOTG,並改善藥物療效(Ⅱ b,B)。
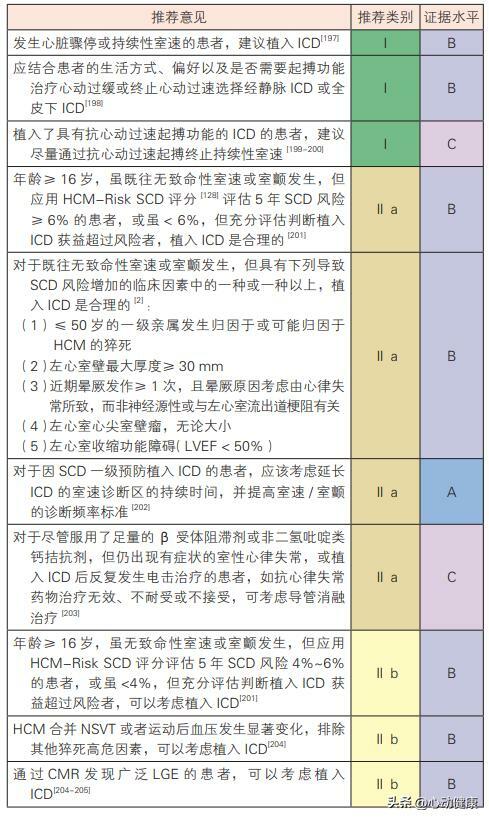
12)器械治療: 器械治療手段包含兩類:ICD 和導管消融治療。 目前認為預防 HCM 患者猝死的可靠方法只有植入 ICD。導管消融治療僅作為減少室性心律失常發作 的輔助手段。鑑於在 60歲以上 HCM 患者中觀察到的猝死事件率較低,現有的猝死一級預防策略最適用於青年和中年 HCM 患者。此外,對於符合猝死一級預防策略的患者,應在患者充分了解風險獲益比 的情況下,與患者共同商討制定 ICD 相關的決策。
HCM 器械治療推薦建議
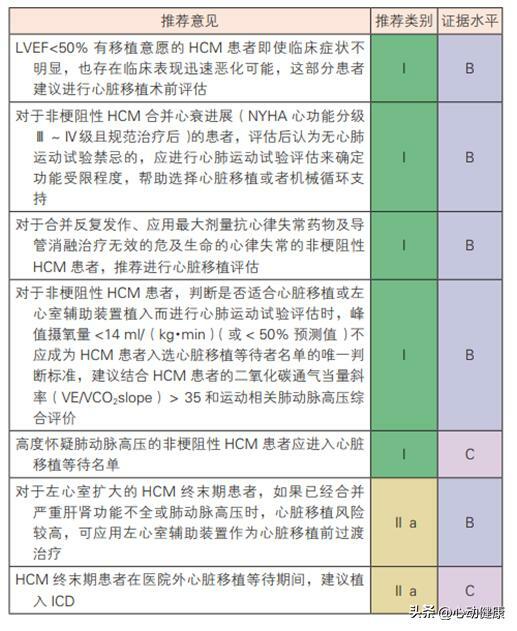
13)終末期治療:心臟移植是 HCM 終末期治療最有效的手段。
14)左心室輔助裝置: 由於 HCM 患者左心室擴大不明顯,LVEF 相對保 留,傳統觀念認為左心室輔助裝置並不適合HCM患者。 然而,近年來一些病例系列報導顯示,左心室舒張末期內徑> 50 mm 的 HCM 患者可能從左心室輔助裝置 植入中獲益,與擴張型心肌病患者相比,HCM 患者左心室輔助裝置術後總體生存率、腦血管不良事件發生率、右心衰竭發生率、心律失常發生率和主動脈瓣 反流發生率較高,但差異無統計學意義 。有限的文 獻顯示,經過謹慎選擇的部分 HCM 患者可選擇左心 室輔助裝置做為心臟移植術前的過渡治療。
HCM 心臟移植及左心室輔助裝置推薦建議
15)妊娠
妊娠時 HCM 的診治 大部分 HCM 的女性能夠耐受妊娠,HCM孕產婦死亡率非常低,妊娠前存在症狀和心血管相關疾 病的高危患者死亡風險增加。心衰和心律失常通常發生在妊娠晚期或產後 ,而合併左心室流出道梗阻的妊娠女性並未增加不良結局。遺傳阻斷和選擇性生育 HCM 患者的孕前遺傳學檢測十分必要。
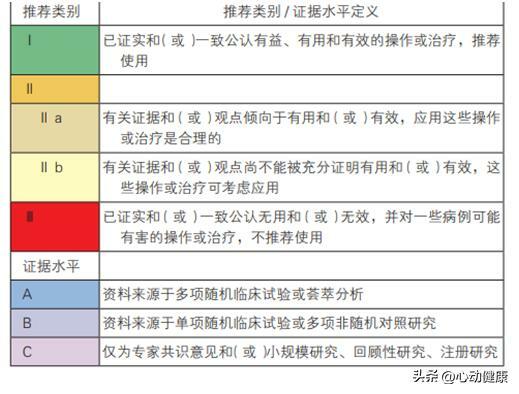
附:推薦類別 / 證據水平的分級及定義