厚朴方舟團隊編譯 | 虎年即將結束,2022年美國FDA已經批准了28款抗癌新療法,包括靶向,免疫檢查點抑制劑,過繼性細胞免疫療法等等,覆蓋了常見的十大實體瘤及血液腫瘤類型,為無數癌症患者帶來了新的希望。
美國批准28款創新療法
1.全球首款BRAF V600E泛癌種療法獲批 不限癌種!
2.RET抑制劑獲批用於實體瘤患者
3.首款非小細胞肺癌新輔助療法獲批
4.首個HER2靶向療法獲FDA加速批准
5.Libtayo進軍肺癌一線治療
6.創新雙免疫療法一線治療肺癌
7.首款輔助治療早期乳腺癌靶向療法
8.Enhertu二線治療乳腺癌獲批
9.首個HER2低表達乳腺癌靶向療法誕生
10.肝癌首款一線雙免疫聯合方案獲批
11.FGFR突變的膽管癌迎來新藥
12.首款膽管癌免疫療法獲批
13.免疫聯合療法獲批食管癌一線治療
14.Keytruda單藥方案獲批用於子宮內膜癌
15.FRα陽性卵巢癌迎來新藥
16.前列腺癌首款靶向放射配體療法獲批上市
17.靶向聯合雄激素剝奪療法獲FDA批准
18. 全球首個T細胞受體(TCR)療法獲批上市
19.全球首款LAG-3抗體療法獲批上市
20.急性髓細胞白血病靶向療法獲FDA批准
21.阿扎胞苷獲批兒童白血病適應症
22.首款CAR-T療法獲批濾泡淋巴瘤
23.大B細胞淋巴瘤全球首款二線CAR-T療法
24.大B細胞淋巴瘤第二款二線CAR-T療法獲批
25.兒童霍奇金淋巴瘤獲批新藥
26.Pemazyre獲批FGFR1重排血液系統腫瘤
27.四線失敗的骨髓瘤患者迎來新藥
28.多發性骨髓瘤BCMA CAR-T療法Carvykti

實體瘤
1.全球首款BRAF V600E泛癌種療法獲批
今年6月,美國FDA加速批准BRAF抑制劑Tafinlar(dabrafenib,達拉非尼)+MEK抑制劑Mekinist(trametinib,曲美替尼)的組合療法,用於治療接受前期療法後疾病出現進展並且沒有滿意的替代治療選擇的,攜帶BRAF V600E的無法切除或轉移性實體瘤成人和6歲以上兒科患者。
Tafinlar+Mekinist是首款獲批不限癌種治療BRAF V600E實體瘤的BRAF/MEK抑制劑,也是BRAF/MEK抑制劑首次獲批用於兒科患者。

2.不限癌種!RET抑制劑獲批用於實體瘤患者
今年9月,美國FDA已加速批准Retevmo(selpercatinib)擴展適應症,不限癌種治療攜帶RET基因融合的局部晚期或轉移性實體瘤患者,包括肺癌、胰腺癌、結直腸癌等實體瘤。此外,美國FDA還授予Retevmo治療RET基因融合的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的完全批准。

非小細胞肺癌
3.首款非小細胞肺癌新輔助療法獲批
今年3月,美國FDA批准重磅PD-1抑制劑Opdivo(nivolumab,納武利尤單抗)與含鉑雙藥化療聯用,作為新輔助療法,治療可切除非小細胞肺癌(NSCLC)患者,無論患者PD-L1表達情況如何。Opdivo聯合化療是首款獲批在手術前治療非小細胞肺癌的免疫療法組合。

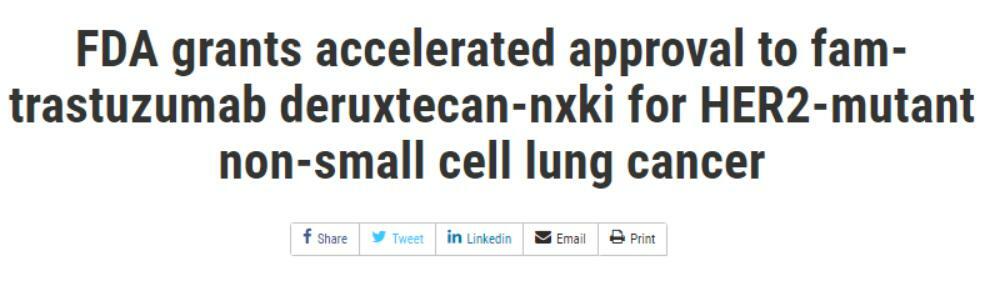
4.首個HER2靶向療法獲FDA加速批准
今年8月,美國FDA宣布抗體偶聯藥物(ADC)Enhertu(DS-8201,T-DXd)擴展適應症,用於治療此前接受過一種系統性治療的,攜帶激活性HER2突變的無法切除或轉移性非小細胞肺癌(NSCLC)患者。Enhertu成為用於HER2突變非小細胞肺癌的首款藥物。
5.Libtayo進軍肺癌一線治療
今年11月,美國FDA已批准PD-1抑制劑Libtayo(cemiplimab rwlc)與鉑類化療聯合用於晚期非小細胞肺癌(NSCLC)成人患者一線治療。這些患者患有轉移性或局部晚期腫瘤,不能進行手術切除或最終化療,無ALK、EGFR或ROS1突變,且無論PD-L1表達水平或腫瘤組織學如何。

6.創新雙免疫療法一線治療肺癌
今年11月,美國FDA批准抗CTLA-4抗體Tremelimumab(Imjudo)與抗PD-L1單克隆抗體Durvalumab(Imfinzi,度伐利尤單抗)聯合化療構成的三重組合療法,用於不攜帶表皮生長因子受體(EGFR)突變或間變性淋巴瘤激酶(ALK)融合的轉移性非小細胞肺癌(NSCLC)成年患者。

乳腺癌
7.首款輔助治療早期乳腺癌靶向療法
2022年3月,PARP抑制劑Lynparza(olaparib,奧拉帕利)已經獲得美國FDA的批准,作為輔助療法,治療攜帶種系BRCA突變(gBRCAm)的高風險HER2陰性早期乳腺癌患者,成為首款在早期乳腺癌患者中靶向BRCA突變的獲批療法。

8.Enhertu二線治療乳腺癌獲批
5月4日,美國FDA已經批准抗體偶聯藥物Enhertu(trastuzumab deruxtecan)用於治療既往接受過一種抗HER2靶向療法治療的,無法切除或轉移性HER2陽性乳腺癌患者[2]。
9.首個HER2低表達乳腺癌靶向療法誕生
8月5日,美國FDA批准 Enhertu (T-DXd,DS-8201)新適應症,用於治療無法切除或轉移性HER2低表達(HER2-low)乳腺癌患者,這是首個獲批用於HER2低表達乳腺癌亞型患者的療法。

肝癌
10.肝癌首款一線雙免疫聯合方案獲批
10月21日,抗CTLA-4抗體Imjudo(tremelimumab)已經獲得美國FDA批准,與抗PD-L1抗體Imfinzi(durvalumab)聯用,治療不可切除的肝細胞癌患者,成為肝癌治療領域的重要選擇!

膽管癌
11.FGFR突變的膽管癌迎來新藥
今年10月,美國FDA已加速批准Lytgobi(futibatinib)上市,用於治療攜帶FGFR2基因融合或其它重排的不可切除、局部晚期或轉移性肝內膽管癌經治成人患者。
12.首款膽管癌免疫療法獲批
美國FDA宣布,批准抗PD-L1抗體Imfinzi(durvalumab,度伐利尤單抗)與化療聯用,一線治療局部晚期或轉移性膽管癌(BTC),這是美國FDA批准的首款用於膽管癌的免疫療法!
食管癌
13.免疫聯合療法獲批食管癌一線治療
今年5月,美國FDA批准兩種基於PD-1抑制劑Opdivo的組合療法:Opdivo與含氟嘧啶和含鉑化療聯用;Opdivo與抗CTLA-4抗體Yervoy聯用,作為一線療法治療晚期不可切除或轉移性食管鱗狀細胞癌。臨床數據顯示,兩種Opdivo聯合療法一線治療食管癌均顯著延長了患者的生存期[13]。
子宮內膜癌
14.Keytruda單藥方案獲批用於子宮內膜癌
2022年3月,美國FDA批准PD-1抑制劑Keytruda(pembrolizumab)單藥治療經FDA批准的檢測發現腫瘤具有微衛星不穩定性高(MSI-H)或錯配修復缺陷(dMMR)特徵的晚期子宮內膜癌患者,為晚期子宮內膜癌患者帶來重要選擇。

卵巢癌
15.FRα陽性卵巢癌迎來新藥
今年11月,美國FDA已加速批准其靶向葉酸受體α(FRα)的抗體偶聯藥物(ADC)Elahere(mirvetuximab soravtansine)上市,作為單藥療法,治療FRα高表達、對含鉑療法耐藥的經治晚期卵巢癌患者。

前列腺癌
16.前列腺癌首款靶向放射配體療法獲批上市
2022年3月,美國FDA已經批准靶向放射性配體療法Pluvicto(曾用名177Lu-PSMA-617)上市,用於治療:已經接受過基於紫杉烷的化療和雄激素受體信號通路抑制劑治療的前列腺特異性膜抗原(PSMA)陽性轉移性去勢抵抗性前列腺癌(mCRPC)患者。Pluvicto是首款FDA批准用於治療這類轉移性去勢抵抗性前列腺癌患者的靶向放射配體療法。

17.靶向聯合雄激素剝奪療法獲FDA批准
今年8月,美國FDA已批准口服雄激素受體抑制劑(ARi)Nubeqa (darolutamide,達羅他胺)聯合多西他賽的補充新藥申請(sNDA),用於轉移性激素敏感性前列腺癌(mHSPC)患者的治療,為前列腺癌患者提供了新的治療方向。

黑色素瘤
18.全球首個T細胞受體(TCR)療法獲批上市
2022年1月,美國食品和藥物管理局(FDA)已批准Kimmtrak(tebentafusp-tebn,IMCgp100):用於治療HLA-A*02:01陽性不可切除性或轉移性葡萄膜黑色素瘤(mUM)成人患者。
Kimmtrak是一種新型T細胞受體(TCR)雙特異性免疫療法,開創了多個第一:①第一個獲得FDA監管批准的TCR療法;②第一個獲得FDA監管批准治療實體瘤的雙特異性T細胞接合器;③第一個也是唯一一個獲得FDA批准治療不可切除性或轉移性mUM的療法。

19.全球首款LAG-3抗體療法獲批上市
3月,FDA批准由固定劑量的抗LAG-3抗體藥物Relatlimab與抗PD-1抗體Opdivo(nivolumab)聯合組成的 「first-in-class」療法Opdualag,治療罹患不可切除或轉移性黑色素瘤的成人和兒童(12歲及以上)患者。Relatlimab是FDA批准的首款LAG-3抗體,也是近十年來針對全新免疫檢查點獲批的首款創新癌症免疫療法。

血液系統腫瘤
20.急性髓細胞白血病靶向療法獲FDA批准
今年5月美國FDA已批准IDH1抑制劑Tibsovo(ivosidenib )與阿扎胞苷聯用,一線治療年齡超過75歲,或由於合併症無法接受強力誘導化療的攜帶IDH1突變的急性髓細胞白血病(AML)患者。
21.阿扎胞苷獲批兒童白血病適應症
今年5月,,美國食品藥品監督管理局(FDA)批准阿扎胞苷(注射用阿扎胞苷,維達莎,5-氮雜胞苷,Vidaza,Azacitidine)用於治療新診斷的幼年型粒單核細胞白血病(JMML)兒科患者。
22.首款CAR-T療法獲批濾泡淋巴瘤
2022年5月,美國食品和藥物管理局(FDA)已加速批准CD19 CAR-T細胞療法Kymriah(tisagenlecleucel):用於治療先前接受過二線或多線系統治療的復發或難治性濾泡性淋巴瘤(r/r FL)成人患者。
23.大B細胞淋巴瘤全球首款二線CAR-T療法
今年4月,FDA批准CAR-T細胞治療藥品Yescarta用於一線化療免疫療法難治或一線化療免疫療法後12個月內復發的大B細胞淋巴瘤(LBCL)成年患者。這也是全球首款獲得FDA批准作為LBCL二線療法的CAR-T藥物。
24.大B細胞淋巴瘤第二款二線CAR-T療法獲批
今年6月,FDA批准了Breyanzi(lisocabtagene maraleucel,liso-cel),用於成人大 B 細胞淋巴瘤患者的二線治療(包括瀰漫性大 B 細胞淋巴瘤、高級別 B 細胞淋巴瘤、原發性縱隔大 B 細胞淋巴瘤和濾泡性淋巴瘤淋巴瘤 3B 級)。
25.兒童霍奇金淋巴瘤獲批新藥
今年11月,FDA批准 brentuximab vedotin (Adcetris) 聯合多柔比星、長春新鹼、依託泊苷、潑尼松和環磷醯胺用於 2 歲及以上既往未經治療的高危經典兒科患者霍奇金淋巴瘤 (cHL)。這是Adcetris首次獲批兒童適應症。
26.Pemazyre獲批FGFR1重排血液系統腫瘤
今年8月,美國食品藥品監督管理局批准 Pemazyre(pemigatinib,Incyte Corporation,培米替尼)用於患有成纖維細胞生長因子受體 1(FGFR1)重排的復發或難治性髓系/淋巴系(MLN)成人血液系統腫瘤。
27.四線失敗的骨髓瘤患者迎來新藥
今年10月,FDA批准 teclistamab-cqyv(Tecvayli)用於之前至少接受過四種治療復發性或難治性多發性骨髓瘤,這是首款雙特異性 B 細胞成熟抗原 (BCMA) 定向 CD3 T 細胞接合劑。
28.多發性骨髓瘤BCMA CAR-T療法Carvykti
2022年2月,BCMA CAR-T療法Carvykti(ciltacabtagene autoleucel,簡稱Cilta-cel)獲得美國FDA批准上市, 用於治療復發或難治性多發性骨髓瘤患者,這些患者既往接受過四種或四種以上的治療,包括蛋白酶體抑制劑、免疫調節劑和抗CD38單克隆抗體。
總而言之,多款藥物的出現,有望為癌症患者提供新的治療方向,讓更多癌症患者受益。
根據美國癌症協會(ACS)和美國國家癌症研究所(NCI)2022年6月發布的數據,總體癌症的5年生存率已達到69%(中國為40.5%),且截至2022年1月,有超過1800萬癌症倖存者生活在美國,美國已經成為無數癌症患者出國就醫的優選。
作為國內知名海外醫療服務機構,厚朴方舟為無數準備出國就醫的患者及家屬提供了遠程會診服務,讓患者和家屬可以足不出戶獲得世界權威專家的診治。另外,厚朴方舟保留的「海外就醫綠色通道」,在疫情期間為許多準備出國看病的患者提供了幫助。目前,赴美就醫已無需隔離,為許多準備就醫的患者提供了便利。
對於準備赴美就醫,但卻對相關政策了解不多的患者及家屬,也可以在厚朴方舟的幫助下進行簽證的辦理、醫院的預約等等,厚朴方舟可以幫助患者及家屬可以在最快時間內趕赴美國,及早開展治療。如果您有前往美國就醫的意向或是想了解更多海外醫療的相關信息,可以通過私信或評論聯繫小編。